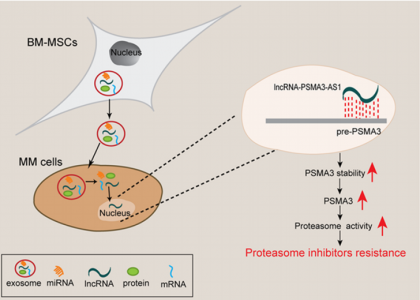
骨髓微环境中释放的外泌体RNA是否影响多发性骨髓瘤的蛋白酶体抑制剂治疗效果此前尚不清楚。来自苏州大学基础医学与生物科学学院庄文卓、苏州大学附属第二医院李炳宗课题组的研究人员发现,外泌体lncRNA -PSMA3-AS1和PSMA3从间充质干细胞转移到多发性骨髓瘤中,并伴随着对蛋白酶体抑制剂耐药的发生。该研究发表于Clinical Cancer Research杂志(IF 10.199)上。
多发性骨髓瘤(Multiple Myeloma,MM)是浆细胞的恶性肿瘤,其特征为浆细胞克隆的增殖。蛋白酶体抑制剂硼替佐米(BTZ)在MM的治疗中显示出良好前景。然而,BTZ抗性严重阻碍了治疗效果。引起蛋白酶体抑制剂的耐药性有多种因素:基因突变、基因表达特征、拷贝数异常和骨髓微环境等。因此MM是一种与遗传、表观遗传和染色体改变相关的多方面疾病,并且MM对蛋白酶体抑制剂耐药的机制仍然是不清楚的。
蛋白酶体是26S酶复合物,由19S调节亚基和20S核心催化亚基组成。20S复合物由两个由7个α亚基组成的环和两个由7个β亚基组成的环组成。蛋白酶体抑制剂对β1亚基(PSMB6)上的肽酰谷氨酰基样活性抑制作用较弱,主要靶向抑制β5亚基(PSMB5)的胰凝乳蛋白酶样活性。在BTZ耐药的血液肿瘤细胞系中检测到β5亚基突变或β5亚基表达增加。然而,在源自BTZ耐药患者的临床样品中并不存在β5突变和过表达。因此,β5亚基失调可能不是蛋白酶体抑制剂耐药的唯一原因。因此还有其他机制可能与蛋白酶体抑制剂耐药性相关。骨髓微环境激活导致疾病进展的许多途径。 MSCs促进肿瘤细胞生长、转移和逃避免疫系统监视。MSCs和骨髓瘤细胞之间的相互作用在MM发病、进展和化疗耐药中起关键作用。这些发现表明需要开发新药来对抗肿瘤与基质之间的相互作用。
外泌体是肿瘤微环境和肿瘤细胞之间的关键传播者。MSCs和MM细胞之间通过外泌体的相互作用在MM发病机制和耐药性中起着至关重要的作用。据报道lncRNA存在于外泌体中。 LncRNA由哺乳动物基因组中的数千个基因座转录,并在多种生物过程中起作用。在肿瘤中,lncRNAs是致癌途径中重要的调节因子。然而,lncRNA在MM发病机制和进展中的作用尚未完全阐明。特别是,来自骨髓微环境的外泌体lncRNA如何促成蛋白酶体抑制剂耐药在MM中是未知的,尤其是反义(Antisense)lncRNA的确切功能及其在MM中的生物发生的分子机制更是知之甚少。
在本研究中,研究人员评估了哪些外泌体RNA以及lncRNA参与蛋白酶体抑制剂耐药性发生过程,以及它们发挥这种功能的分子机制。他们认为,外泌体lncPSMA3-AS1是通过调节编码蛋白酶体亚基α7的PSMA3的稳定性来介导对蛋白酶体抑制剂耐药的关键决定因素。 PSMA3的上调导致胰凝乳蛋白酶样蛋白酶体活性相关的的α-亚基增加。并且发现,MSCs中的PSMA3和PSMA3-AS1可以包装到外泌体中并转移到骨髓瘤细胞中,进而促进了蛋白酶体抑制剂耐药性的发生。 PSMA3-AS1可以与pre-PSMA3形成RNA双链结合体,其通过增加mRNA转录稳定性促进PSMA3表达。在异种移植瘤模型中,研究人员发现静脉内注射siPSMA3-AS1可有效增加卡非佐米的药物敏感性。此外,源自多发性骨髓瘤患者的血浆循环外泌体PSMA3和PSMA3-AS1与无疾病进展生存期以及总生存期显著相关。本研究提示外泌体PSMA3和PSMA3-AS1在从MSCs向多发性骨髓瘤细胞传递蛋白酶体抑制剂耐药中的独特作用,并揭示了新的外泌体PSMA3-AS1 / PSMA3信号通路。外泌体PSMA3和PSMA3-AS1可能作为蛋白酶体抑制剂耐药的新的治疗靶标和临床反应的预后预测因子。
参考文献:Xu H, Han H, Song S, Yi N, Qian C, Qiu Y, Zhou W, Hong Y, Zhuang W, Li Z, Li B, Zhuang W. Exosome-Transmitted PSMA3 and PSMA3-AS1 Promote Proteasome Inhibitor Resistance in Multiple Myeloma. Clin Cancer Res. 2019 Jan 4.
doi: 10.1158/1078-0432.CCR-18-2363.