腹膜扩散是晚期胃癌患者中最常见转移方式,然而其中扩散的机制仍不清楚。来自北京大学肿瘤医院沈琳课题组的研究人员发现,胃癌患者的恶性腹水来源的外泌体能促进肿瘤细胞腹膜扩散,并揭示了这些外泌体的miRNA表达特征。该研究发表于Cancer Letters杂志上。
胃癌是全球第五大致死性恶性肿瘤,也是癌症相关死亡的第三大原因。腹膜播散(Peritoneal dissemination,PD)是胃癌最常见的转移方式,与胃癌向远端器官的其他转移方式相比,腹膜播散的死亡率更高。如果不进行治疗,腹膜转移的胃癌患者的中位生存期仅为3-5个月,5年生存率为2%。对于腹膜播散的胃癌来说,目前的治疗方式不明确并且仍然不能令人满意。因此,需要揭示腹膜播散的潜在机制,以及开发更多胃癌腹膜播散的治疗靶标。
外泌体是由多囊泡内体产生的膜囊泡,直径范围在30到100nm之间。外泌体几乎在所有类型的细胞中释放,并且在多种体液中富集,包括血浆、唾液、尿液和恶性胸腔积液等。大量研究表明,外泌体在细胞通讯中发挥关键作用,在细胞间转移蛋白质、脂质、DNA和RNA(如microRNA和mRNA)。肿瘤来源的外泌体可以通过重编程肿瘤微环境和改变细胞外基质来吸引更多肿瘤细胞在远端定植,从而促进肿瘤转移。研究表明,胃癌来源的外泌体通过破坏间皮屏障、诱导腹膜纤维化来促进腹膜转移。胃癌患者恶性腹水中分离的外泌体可促进间皮细胞增殖,并将间皮细胞转化为肿瘤相关成纤维细胞(CAFs),从而促进腹膜转移。因此,源自肿瘤细胞的外泌体在胃癌腹膜转移过程中的转移前环境的形成中至关重要。然而,其中通过外泌体对腹膜转移起调节作用的具体机制仍然不清楚。
外泌体富含来自其亲代细胞的一部分microRNA(miRNA)。miRNA是约22个核苷酸的非编码RNA,通过转录后调节作为癌基因或肿瘤抑制因子调节基因表达。miRNA在多种癌症发展中表达失调,一些miRNA可作为诊断、预后和预测性生物标志物。研究发现,一些外泌体miRNA特征是肿瘤潜在生物标志物,特异性外泌体miRNA表达谱可作为诊断和预后生物标志物的潜在候选者。一些研究已经确定了胃癌中不同的外泌体miRNA谱。血清外泌体miRNA(miR-10b-5p、miR-132-3p、miR-185-5p、miR-195-5p、miR-20a-3p、miR-296-5p)在胃癌患者组织中高表达。血清外泌体miR-19b-3p和miR-1106a-5p是胃癌的潜在诊断生物标志物。腹腔灌洗的miR-21和miR-1225-50可作为胃癌切除术后腹膜复发的新型潜在诊断标志物。然而,恶性腹水来源的外泌体在胃癌腹膜播散过程中的作用尚不清楚,并且外泌体通讯影响肿瘤细胞的分子机制尚不清楚。
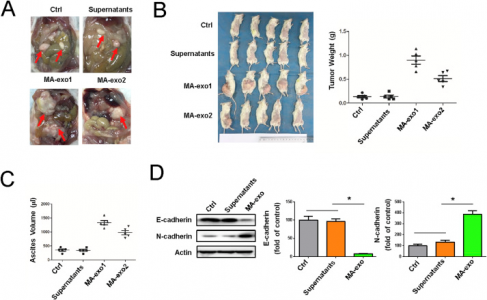
在这项研究中,研究人员评估了来自胃癌患者的恶性腹水衍生外泌体的作用,并在体外实验和体内小鼠模型中检测了外泌体对胃癌细胞的侵袭作用。此外,研究人员还评估了来自3个胃癌患者和3个非恶性疾病患者的腹水中的外泌体miRNA谱,鉴定了非恶性腹水和恶性腹水之间的差异miRNA表达特征。。
结果发现,体外和体内分析显示,来自胃癌患者的恶性腹水的外泌体通过上调上皮间质转化(EMT)信号传导促进AGS细胞的侵袭。在小鼠腹部异种移植模型中,恶性腹水中的外泌体处理后的小鼠中位存活期缩短。与非恶性患者相比,患有胃癌患者的腹水来源的外泌体具有更高水平的miR-196、miR-92和miR-1307。总之,来自胃癌患者的恶性腹水的外泌体促进胃癌细胞和小鼠腹膜肿瘤模型中的EMT信号传导,这些差异外泌体miRNA可能用于抑制腹膜转移的治疗,这为胃癌中腹膜扩散的分子机制提供了新的见解。
图:恶性腹水中的外泌体对胃癌细胞增殖转移的影响
参考文献:Hu Y, Qi C, Liu X, Zhang C, Gao J, Wu Y, Yang J, Zhao Q, Li J, Wang X, Shen L. Malignant ascites-derived exosomes promote peritoneal tumor cell dissemination and reveal a distinct miRNA signature in advanced gastric cancer. Cancer Lett. 2019 May 7.