土豆
肝细胞癌分泌的外泌体介导了肿瘤的发展和转移,而这些功能依赖于外泌体中的RNA和蛋白质成分的参与。转运必需内吞体分选复合物(ESCRT)亚基之一Vps4A通过影响肝细胞癌外泌体中的microRNA实现肿瘤抑制,然而Vps4A是否也会把蛋白质分选到外泌体中此前是不清楚的。近日,来自中山大学孙逸仙纪念医院闵军课题组和中山大学药学院刘培庆课题组的研究人员在Cancer Letters(IF 6.491)杂志发表文章,证实了Vps4A具有调节β-catenin蛋白质的质膜定位和外泌体分选的作用,降低细胞核内β-catenin信号传导活性,进而抑制肝细胞癌的EMT进程和转移。
肝细胞癌(HCC)是全球第六大常见癌症,也是全球癌症相关死亡的第三大原因。尽管对HCC有多种治疗方案,但HCC患者的长期预后仍然很差。肿瘤转移是HCC患者死亡的主要原因,因此探究HCC转移的机制将非常重要。
转运必需内吞体分选复合物(ESCRT,主要结构包含ESCRT-0 到 –III以及 Vps4亚基)调节生物膜重塑和解聚中的作用。ESCRT参与了多泡体(MVB)和外泌体的形成、膜修复、胞质分裂和病毒出芽等过程。人体内的Vps4A和Vps4B组成AAA + ATP酶Vps4,其作用是促进ESCRT-III的分解。ESCRT在蛋白质分选到胞内体、中心体和质膜过程中起着至关重要的作用,其中ESCRT-III和Vps4是上述生物过程所必需的亚基。然而,Vsp4A在包括HCC在内的肿瘤中的功能尚未得到很好的研究。尽管研究人员此前发现Vps4A通过影响HCC中外泌体及其亲代细胞的microRNA谱来发挥肿瘤抑制作用,然而其中的详细机制仍不清楚。
上皮间质转化(EMT)被认为是肿瘤细胞转移的关键步骤。在转化过程中,上皮标志物如E-cadherin减少,而间充质标志物如N-cadherin和Vimentin增加。此外,一些转录因子如Snail、Twist 1和ZEB控制着这些标志物之间的转换。这些基因的表达谱根据EMT状态的变化而变化。
β-catenin作为Wnt信号通路的中枢成分和转录共激活因子,在包括HCC在内的许多癌症中被异常激活,并参与肿瘤发生和EMT的调节。一旦Wnt级联信号被激活,β-catenin就从细胞质转移到细胞核,并通过调节靶基因的表达直接或间接地促进EMT。β-catenin还通过直接与质膜上的E-cadherin相互作用而促进粘附连接的形成。因此,β-catenin在调节EMT中起双重作用,这取决于其亚细胞定位。然而,β-catenin不同的定位方式的形成机制尚不清楚。
外泌体是小的细胞外膜囊泡(40-200nm),通过MVB与质膜的融合释放。在外泌体中可以检测到蛋白质、脂质和各种RNA。肿瘤细胞可以通过将外泌体转移到受体细胞来与其他细胞进行通信和信号传导。通过调节含有细胞内容物的外泌体的分泌,细胞可以维持其体内平衡或改变其细胞信号级联的活性。越来越多的证据表明外泌体参与肿瘤侵袭、转移和EMT,并且外泌体可以用作肿瘤诊断的生物标志物。然而,细胞内容物在外泌体的选择性分选以及外泌体在肿瘤EMT中的作用的机制尚未完全阐明。
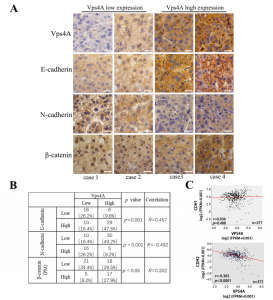
在这项研究中,研究人员发现Vps4A与CHMP4B和β-catenin相互作用,并且Vps4A在介导β-catenin的质膜定位和外泌体分选中起关键作用。通过免疫沉淀Vps4A复合物的质谱分析,研究人员证实Vps4A与β-catenin和CHMP4B之间具有相互作用。通过这种相互作用,Vps4A促进了β-catenin的质膜定位和外泌体释放。沉默Vps4A或CHMP4B降低了β-catenin的质膜定位和外泌体分选。Vps4A过表达降低β-catenin信号通路,抑制EMT和HCC细胞运动。并且,沉默Vps4A或CHMP4B能够促进HCC的EMT。此外,Vps4A的表达与人HCC组织中几种EMT标志物的表达显著相关,并且转移性HCC患者的外泌体β-catenin水平显著低于对照组患者。该研究揭示了Vps4A调节HCC细胞的EMT和运动的新机制,这些发现可能提供了新的生物标志物并促进HCC治疗策略的发展。
图:HCC患者组织样本中Vps4A表达与EMT标志物之间的相关性
参考文献:Han Q, Lv L, Wei J, Lei X, Lin H, Li G, Cao J, Xie J, Yang W, Wu S, You J, Lu J, Liu P, Min J. Vps4A mediates the localization and exosome release of β-catenin to inhibit epithelial-mesenchymal transition in hepatocellular carcinoma. Cancer Lett. 2019 May 3;457:47-59.