土豆
小细胞外囊泡(Small extracellular vesicles,SEV)为组织再生提供了有希望的策略,但SEV的短寿命限制了它们在受损组织中的功效。来自葡萄牙科英布拉大学的研究人员发现,SEV传递和释放的动力学对组织再生具有不同的影响,控制SEV延时释放能力的工程化生物材料可以协助组织再生过程。该研究发表于ACS Nano(影响因子13.903)杂志上。
外泌体属于小细胞外囊泡(SEV),是细胞来源的囊泡,直径50-200nm,包含有miRNA以及其他生物分子(如蛋白质、脂质、mRNA)的混合物,在细胞/组织通讯中具有重要作用。SEV中的生物分子的转移调节着受体细胞的生物学功能,最终可能影响组织再生。例如, 从间充质细胞、造血细胞、干细胞或祖细胞来源的SEV中的miRNA或蛋白质可以转移至到心脏、胰腺、缺血组织或皮肤细胞,证明SEV调节血管形成、细胞增殖、迁移以及其他生物功能。SEV的作用很大程度上取决于它们的来源组织、分离方法、给药途径、剂量和靶向组织。对动物全身进行SEV注射,会发现脾脏和肝脏中SEV的主要积累,并且大多数SEV在注射后6小时被清除。在受损组织的局部施用SEV具有靶向功效,然而这些囊泡寿命却很短暂,并且与蛋白酶或pH的变化影响无关。这是因为SEV会被各种组织细胞迅速吸收,包括免疫和内皮细胞。这些囊泡在几分钟内以单个囊泡的形式被其他细胞吸收,大部分SEV(40-60%)似乎在数小时后在溶酶体中积累,含量也因此降低,剩余的SEV在细胞质中释放它们的内容物。由于组织再生需要在不同时间介入多种生物分子,所以单次施用SEV很难使其再生潜力最大化。
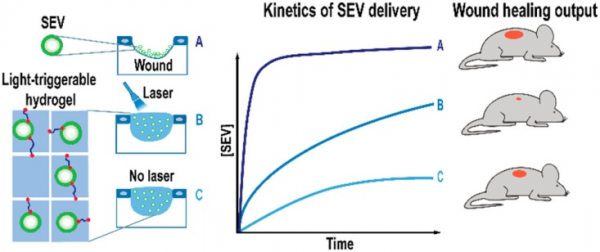
研究人员认为,SEV的组织再生潜力取决于SEV向受损组织的递送动力学的改变。研究人员在慢性伤口愈合的背景下验证了这一假设。伤口愈合是一个复杂的过程,涉及多个生物分子在不同时间的干预。例如,miR-16、miR-21和miR-29b在伤口愈合期间的炎症、增殖和成熟三个不同的时间阶段分别起作用。慢性伤口的常规治疗包括定期伤口清创术(即去除坏死组织、外来碎片和感染),刺激愈合过程并通过特定敷料保护伤口。目前,除了1997年批准用于刺激慢性下肢糖尿病性神经性溃疡愈合的Regranex药物之外,仍缺乏其他加速慢性伤口再生的制剂。最近的临床前研究表明,SEV具有通过加速上皮重塑和新血管形成来帮助慢性伤口愈合,但由于SEV的寿命短,再生愈合能力受到限制。如果最大化SEV的再生潜能,需要多次施用SEV,但这并不可取,因为每次施用都需要医务人员协助,每次给药都可能破坏伤口愈合过程。而单次施用含有SEV的制剂(例如水凝胶)能够延时释放SEV并提供用于细胞浸润和粘附的临时细胞外基质。在水凝胶降解期间,细胞将渗入水凝胶占据的空间并受SEV的干预。
具有控制SEV延时释放能力的工程化生物材料可以协助组织再生过程。水凝胶在愈合过程中释放出SEV,水凝胶占据的空间被从邻近区域增殖和迁移的细胞所取代。 SEV在包括水凝胶在内的载体中的应用在先前的研究中得到证实,然而未有研究比较过从载体中控制释放的SEV与单次施用SEV的区别,SEV的控制释放的再生效果、体内SEV释放、释放SEV的分子机制均未有过研究。因此,在此前未有研究证明SEV的传递动力学在组织、细胞和分子水平的组织再生中的影响。
在这项研究里,研究人员发现SEV的多次控制定时施用比单次施用相同量的SEV具有更好的再生作用。重要的是,相比于用单次或多次SEV治疗或者用血小板衍生长因子BB(FDA批准的伤口再生疗法)治疗,单次剂量施用含有SEV的光触发水凝胶治疗的糖尿病和非糖尿病相关伤口愈合动力学增加明显。释放的SEV的促愈合活性表现为在组织/细胞水平上的皮肤新血管形成和再上皮化增加。在分子水平,在伤口愈合期间不同时间的7种miRNA的表达发生改变,其中包括介导皮肤再生的has-miR-150-5p。因此SEV传递和释放动力学能够调节组织、细胞和分子水平的组织再生过程。
参考文献:Henriques-Antunes H, Cardoso RMS, Zonari A, Correia J, Leal EC, Jiménez-Balsa A, Lino MM, Barradas A, Kostic I, Gomes C, Karp JM, Carvalho E, Ferreira L. The Kinetics of Small Extracellular Vesicle Delivery Impacts Skin TissueRegeneration. ACS Nano. 2019 Aug 16. doi: 10.1021/acsnano.9b00376.