作者:企鹅
近日,Nature 子刊 Nature Communications 杂志发表了华中科技大学生命学院、国家纳米药物工程技术研究中心杨祥良教授、甘璐教授课题组与芬兰赫尔辛基大学研究人员合作的题为:Tumor exosome-based nanoparticles are efficient drug carriers for chemotherapy 的研究论文。该研究构建了一种肿瘤细胞分泌的包裹仿生多孔硅纳米颗粒的外泌体(E-PSiNPs),用于肿瘤干细胞的靶向给药,具有良好的抗肿瘤和杀伤肿瘤干细胞能力。
基于纳米颗粒的药物递送系统(Nanoparticles-based drug delivery systems, NDDS)具有增强的渗透性和驻留效应(enhanced permeability and retention, EPR),在癌症治疗应用中具有独特的优势。为了增加抗肿瘤药物向肿瘤靶向递送的能力,纳米颗粒通常用靶向抗体、肽或其他生物分子进行功能化。然而,由于免疫作用增强,靶向配体的存在有时可能对纳米颗粒递送具有负面影响。此外,使用靶向配体让这些功能化纳米颗粒具有靶向性是不可能的,并且对于广泛的癌症而言是不精确的,因为肿瘤具有遗传多样性或表型异质性。
结合天然生物材料(例如细胞或细胞膜)的独特功能以及合成纳米颗粒的工程多功能性的仿生纳米颗粒最近作为有效的药物递送平台而引起了相当大的关注。纳米颗粒可以被来自红细胞(RBC)、癌细胞、血小板或白细胞(WBC)的各种细胞膜包被,并且已经显示出良好的生物相容性,延长的循环时间以及更好的肿瘤靶向。
外泌体是哺乳动物细胞分泌的小细胞外囊泡,由于其循环稳定性、生物相容性、低免疫原性和低毒性,被用作纳米载体。此外,外泌体显示出有效的细胞摄取和靶向归巢能力取决于其膜的蛋白质。鉴于外泌体的表面蛋白质组成可能对其功能至关重要,外泌体膜完整性和稳定性的保存对于它们在药物递送中的应用非常重要。通常,外泌体-仿生纳米颗粒通过迭代物理挤出或冷冻/解冻循环构建以融合外泌体和纳米颗粒,这可能影响外泌体膜上的蛋白质完整性,从而损害这些仿生纳米颗粒的生物功能。因此,非常需要开发一种有效的方法来构建外泌体-仿生纳米颗粒而不干扰癌症治疗的膜完整性。
发光多孔硅纳米颗粒(Luminescent porous silicon nanoparticles, PSiNPs)由于其优异的载药能力,高生物相容性和生物降解性而被广泛用作药物载体。该研究开发了一种生物相容性肿瘤细胞-胞吐外泌体护套PSiNPs(E-PSiNPs)作为靶向癌症化学疗法的药物载体。当肿瘤细胞与载有阿霉素的PSiNP(DOX@PSiNPs)一起孵育时,肿瘤细胞会分泌载有DOX@PSiNPs的外泌体(DOX @ E-PSiNPs)。
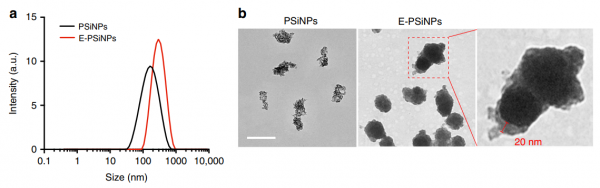
- 通过DLS分析,PSiNPs和E-PSiNP的流体动力学直径。b. PSiNPs和E-PSiNP的透射电子显微镜图像。
研究数据显示,从107个癌细胞分泌的的E-PSiNPs的总蛋白量为60 μg,但是通过差速超速离心从相同数量的癌细胞中检测到的天然分泌的外来体中仅有1.8 μg蛋白质。PSiNPs刺激细胞产生了近34倍之多的外泌体。
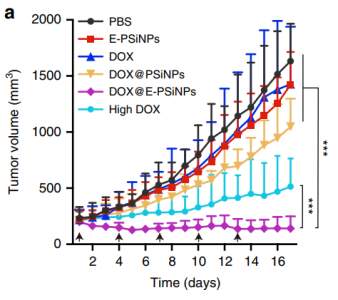
静脉注射PBS、E-PSiNPs、游离DOX(0.5 mg/kg或高浓度4 mg/kg)、DOX@PSiNPs、DOX@E-PSiNPs后,H22荷瘤小鼠的肿瘤生长曲线。
DOX@E-PSiNPs对大量癌细胞和癌症干细胞(CSCs)具有强烈的交叉反应性、细胞摄取和细胞毒性,这些细胞负责肿瘤发生,肿瘤进展、复发、转移和耐药性。此外,DOX@E-PSiNPs表现出增强的肿瘤积聚、血管外渗和深入渗透到肿瘤实质中。DOX@E-PSiNPs的这些特征导致它们在具有CSCs特征的总肿瘤细胞和侧群细胞中更大的体内富集,因此在皮下、原位和转移性肿瘤中产生显著的抗癌和CSC杀伤活性。
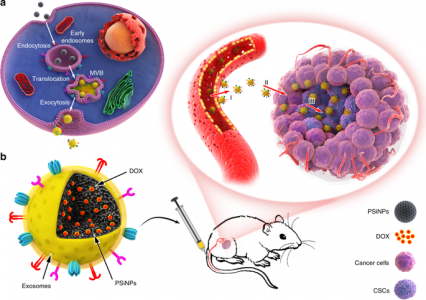
E-PSiNPs作为靶向癌症化学疗法的药物载体的示意图。a. DOX@E-PSiNPs制备的示意图。DOX@PSiNPs在孵育后被内吞至癌细胞,然后定位于多泡体(MVB)和自噬体中。在MVB或自噬体与细胞膜融合后,DOX@E-PSiNPs被胞吐到细胞外空间。b. 示意图显示DOX@E-PSiNPs在静脉注射到荷瘤小鼠后如何有效靶向肿瘤细胞。(I)DOX@E-PSiNPs在肿瘤组织中有效积累; (II)DOX@E-PSiNPs深入穿透肿瘤实质; (III)DOX@E-PSiNPs有效地内化到大量癌细胞和CSC中以产生强大的抗癌功效。
总之,该研究提供了一种癌症治疗方法,通过使用从肿瘤细胞中排出的外泌体-仿生纳米颗粒作为药物载体来有效地递送抗癌药物。