土豆
病毒性心肌炎是一种致命性疾病,并且目前缺乏特定的治疗方法。而心脏祖细胞(CPC)分泌的外泌体具有心脏保护和修复的价值。来自中南大学湘雅三医院李欣课题组的研究人员发现,CPC分泌的外泌体在病毒性心肌炎模型中对心肌细胞具有保护作用,其机理是降低病毒增殖以及调节mTOR、Bcl-2、Caspase信号通路实现的。这项工作为病毒性心肌炎提供了一种可能的细胞疗法,该研究发表于Cell Death and Disease杂志上。
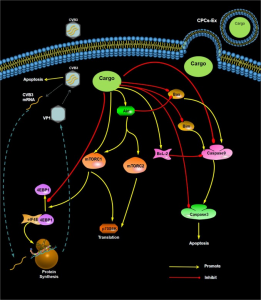
CPC衍生的外泌体(CPCs-Ex)工作示意图
病毒性心肌炎(Viral myocarditis,VMC)是扩张型心肌病和心源性猝死的常见原因。寻找有效的VMC疗法仍然是一个巨大的挑战,而关于心脏祖细胞(cardiac progenitor cells,CPC)的研究可能为VMC的治疗提供一个转折点。
CPC是一组分布在整个心脏的异质细胞,能够分化为特定的几种细胞类型,包括心肌细胞(CMs)、血管平滑肌细胞和内皮细胞(ECs),为心脏再生和功能重建提供了广阔的前景。到目前为止,干细胞治疗在心脏修复方面取得了令人鼓舞的结果。此外,与来自骨髓或脂肪组织的干细胞相比,来自成年心脏的CPCs已成为心脏细胞治疗的最好的候选者。然而,CPC直接在体内转分化为心脏组织被认为是不可能实现的。研究表明,成人干细胞治疗的机制是通过旁分泌释放含有生长因子和细胞因子的细胞外囊泡来发挥抗凋亡、抑制免疫和促进血管生成的作用,外泌体是源自CPCs的细胞外囊泡的主要活性成分。
外泌体是在生理和病理条件下从树突状细胞(DC)、巨噬细胞、T细胞和其他组织起源的细胞通过胞吐作用分泌的纳米级(30–100 nm)颗粒,携带有蛋白质、脂质和调节性核酸,例如外泌体可以将小分子RNA和大的非编码RNA传递到受体细胞中。一些临床前研究表明,与细胞移植相比,CPC衍生的外泌体(CPCs-Ex)对心脏修复具有更好的治疗作用。实际上,包含特定药物或试剂的CPCs-Ex已被有效地用于治疗心血管疾病。在急性心肌缺血再灌注小鼠模型中,Sca1 + CPCs-Ex可以通过抑制caspase-3 / 7来减少细胞凋亡。富含miR-21的CPCs-Ex通过靶向PDCD412来预防心肌细胞凋亡。一项对新生儿CPCs-Ex进行了深入的蛋白质组学分析发现外泌体中存在着高水平的胰岛素样生长因子-1(可促进心脏保护、抑制细胞凋亡),提示CPCs-Ex具有抗凋亡作用。
柯萨奇病毒B(CVB)是微小RNA病毒家族的成员,是一种常见的肠病毒,可引起各种人类全身性炎症性疾病,例如心肌炎、脑膜炎和胰腺炎,而六种CVB血清型分别会造成不同的疾病和症状,其中婴儿和儿童更容易受到CVB的侵害。
CVB诱导的VMC目前缺乏有效的治疗方法。几种临床前干细胞疗法在减少炎症和改善心肌功能方面取得了一些进展,但仍不能令人满意。作为一种无细胞的治疗方法,外泌体可以避免许多细胞治疗的局限性。CPCs-Ex可以预防星形孢菌素诱导的心肌细胞凋亡,并且比MSCs分泌的外泌体具有更好的心脏保护作用。但是,CPCs-Ex在VMC中的作用仍未被研究。
在这项研究中,研究人员旨在探索CPC衍生的外泌体(CPCs-Ex)是否可以通过mTOR信号途径减少病毒性心肌炎(VMC)的细胞凋亡。在体外实验里,CVB3病毒感染H9C2细胞后添加外泌体,以检测CPCs-Ex的抗凋亡作用。与对照组相比,外泌体处理后的细胞凋亡率降低,同时病毒衣壳蛋白1(VP1)的表达下降,Bim / caspase家族的促凋亡因子表达降低。同时,CPCs-Ex促进了Akt、mTOR和p70S6K的磷酸化,抑制了4EBP1的磷酸化。在体内实验里,感染CVB3的心肌细胞的凋亡情况、CVB3和促凋亡因子的表达以及Akt / mTOR因子的磷酸化结果与体外实验结果一致。研究人员用雷帕霉素和MK-2206抑制Akt / mTOR信号通路,同时将大鼠4EBP1、p70S6K、Akt1和Akt2转染H9C2细胞里建立了稳定转染的细胞系。在雷帕霉素或MK-2206处理组中,CPCs-Ex降低了H9C2细胞的凋亡和CVB3 mRNA的表达。在Akt2、p70S6K和4EBP1过表达组中,CPCs-Ex促进CVB3诱导的细胞凋亡、促进了VP1表达和caspase-3的裂解。因此, CPCs-Ex通过抑制CVB3的病毒增殖并调节mTOR信号通路以及Bcl-2和caspase家族的表达,在CVB3感染的细胞中发挥抗凋亡作用。
病毒性心肌炎主要由CVB3感染引起,目前尚缺乏特定的治疗方法,该研究确定了CPCs-Ex在CVB3感染的细胞和大鼠中的抗凋亡作用,表明CPCs-Ex可能是治疗病毒性心肌炎的有效工具。研究人员相信,随着对CPCs-Ex功能的更深入研究,在治疗病毒性心肌炎方面将取得更多突破。
参考文献:Li X, Yang Z, Nie W, Jiang J, Li S, Li Z, Tian L, Ma X. Exosomes derived from cardiac progenitor cells attenuate CVB3-induced apoptosis via abrogating the proliferation of CVB3 and modulating the mTOR signaling pathways. Cell Death Dis. 2019 Sep 18;10(10):691.