近日,来自美国俄亥俄州立大学的L. James Lee教授、梅奥医学中心Betty Y. S. Kim教授、中国 吉林大学滕乐生教授合作在Nature Biomedical Engineering杂志(影响因子17.135)上发表文章,报道了大量产生携带功能mRNA的外泌体用于疾病治疗的方法,该方法促进细胞产生的外泌体高达50倍,其携带的功能性mRNA转录本增加超过10倍以上,从而解决外泌体提取后电转载药的低效率问
 法在治疗多种人类疾病方面具有巨大潜力。然而,基于核酸的疗法的主要局限性是相对较大且带负电荷的分子无法有效地递送至目标细胞和组织中。多年来,人们已经开发了多种用于体内核酸递送的技术,包括病毒载体和合成的纳米载体(例如脂质体和聚合物纳米颗粒)。但是,这些策略存在与毒性和免疫原性、生产制造问题(例如质量控制和高成本)以及无法跨越特殊的生理屏障(如血脑屏障)运送有效成分等许多问题。最近,细胞分泌的细胞外膜泡(EVs),如外泌体,已经成为基于核酸的治疗药物的有希望的载体。
法在治疗多种人类疾病方面具有巨大潜力。然而,基于核酸的疗法的主要局限性是相对较大且带负电荷的分子无法有效地递送至目标细胞和组织中。多年来,人们已经开发了多种用于体内核酸递送的技术,包括病毒载体和合成的纳米载体(例如脂质体和聚合物纳米颗粒)。但是,这些策略存在与毒性和免疫原性、生产制造问题(例如质量控制和高成本)以及无法跨越特殊的生理屏障(如血脑屏障)运送有效成分等许多问题。最近,细胞分泌的细胞外膜泡(EVs),如外泌体,已经成为基于核酸的治疗药物的有希望的载体。
这些分泌的EVs具有生物相容性,直径为40-150 nm,并固有表达跨膜和膜锚定蛋白。这些蛋白质的存在延长了其血液循环的“半衰期”,促进了组织定向递送,并促进了细胞对外泌体内容物的吸收。尽管它们具有许多优势,但由于产生足够数量的核酸用于体内在技术上具有挑战性,因此限制了外泌体在基因传递中的应用。首先,仅发现有限数量的细胞来源能够分泌临床转化所需的足够数量的外泌体。其次,为了产生临床剂量的外泌体,必须培养大量的细胞,接着纯化和载入核酸,然后才能获得最终的含核酸外泌体。
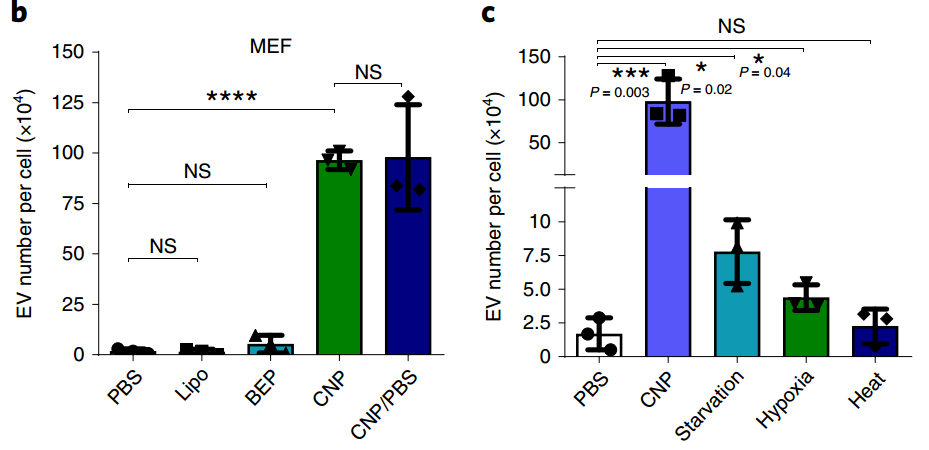
尽管通过常规批量电穿孔(BEP)将小干扰RNA和短发夹RNA质粒后载入外泌体已显示出比合成纳米载体更高的抑制临床前胰腺癌模型中致癌靶标的治疗功效,但将大核酸插入纳米级外泌体中技术上仍具有挑战性,可能仅限于特定细胞类型的外泌体。尽管有研究已提出了生物学修饰细胞来源以促进RNA在外泌体中包裹的策略,但在不进行基因修饰的情况下,诱导从多种有核细胞来源释放出载有所需核苷酸转录物的大量外泌体,还是一个有待解决的问题。该报道研究了一种非遗传策略,可以有效地将高水平的mRNA掺入外泌体中,以进行靶向转录操作和治疗。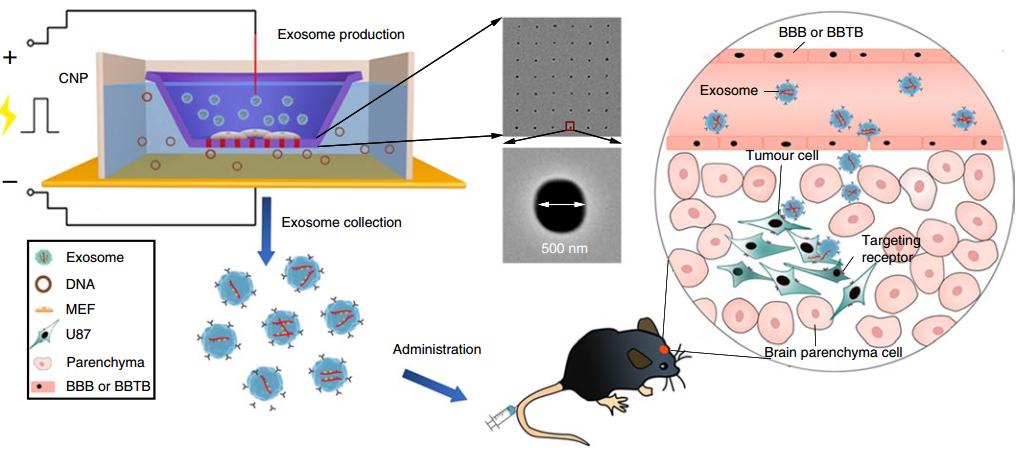
细胞纳米穿孔(CNP)生成的EV用于核酸靶向递送的示意图
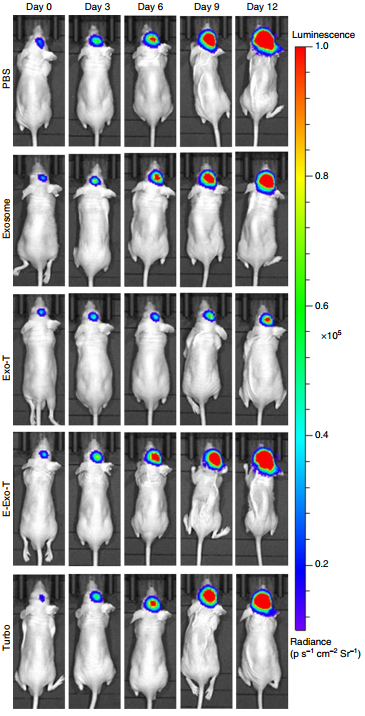
外泌体作为核酸载体是有吸引力的,因为它们具有良好的药代动力学和免疫学特性,并且能够穿透合成药物递送载体不可渗透的生理屏障。然而,将外源核酸,特别是大的信使RNA插入细胞分泌的外泌体,仍然效率很低。该研究报告了一种用于生产大量含有治疗性mRNA和靶向肽的外泌体的细胞纳米穿孔方法。用质粒DNA转染了各种来源的细胞,并通过局部和瞬时电刺激刺激细胞,这些刺激促进了携带转录的mRNA和靶向肽的外泌体的释放。与整体电穿孔和其他外泌体生产策略相比,细胞纳米穿孔产生的外泌体多达50倍,而外泌体mRNA转录本的增加超过103倍,即使来自基础分泌水平较低的细胞也是如此。在原位磷酸酶和张力蛋白同源物(PTEN)缺陷的神经胶质瘤小鼠模型中,含mRNA的外泌体恢复了肿瘤抑制功能,增强了对肿瘤生长的抑制作用并增加了存活率。细胞纳米穿孔可以将外泌体用作需要转录操作的通用核酸载体。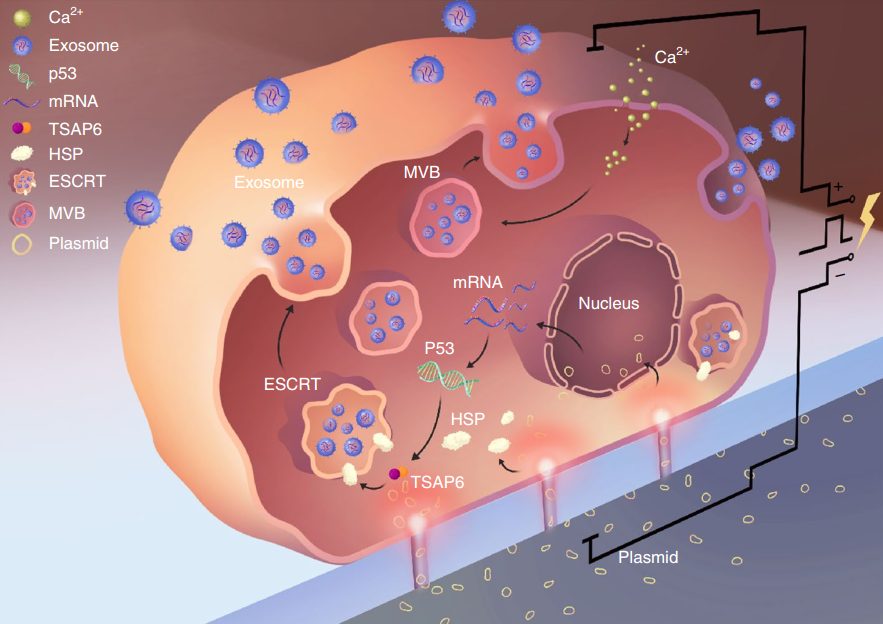
U87原位神经胶质瘤模型中CNP刺激产生的外泌体的体内治疗效果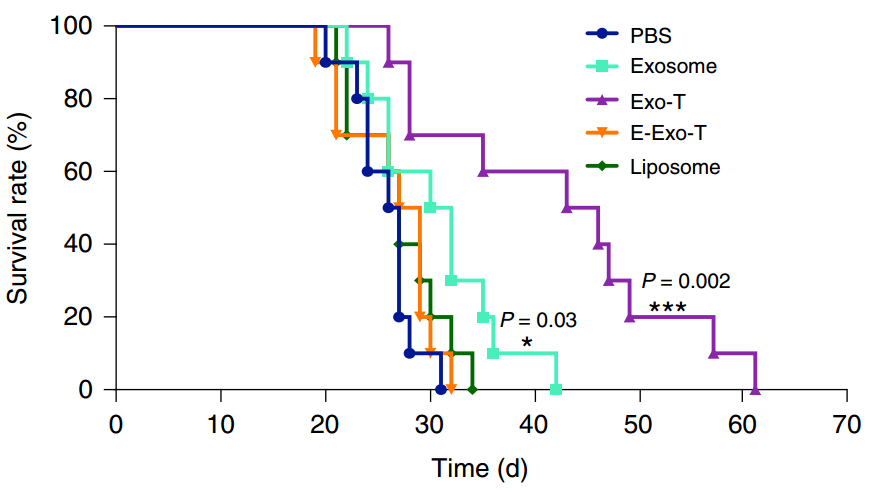
在GL261原位神经胶质瘤模型中CNP刺激产生的外泌体的体内治疗功效
参考文献:
Yang Z, Shi J, Xie J, Wang Y, Sun J, Liu T, Zhao Y, Zhao X, Wang X, Ma Y, Malkoc V, Chiang C, Deng W, Chen Y, Fu Y, Kwak KJ, Fan Y, Kang C, Yin C, Rhee J, Bertani P, Otero J, Lu W, Yun K, Lee AS, Jiang W, Teng L, Kim BYS, Lee LJ. Large-scale generation of functional mRNA-encapsulating exosomes via cellular nanoporation. Nature Biomedical Engineering. 2019 Dec 16. doi: 10.1038/s41551-019-0485-1. [Epub ahead of print] IF= 17.135