近日,南京大学李朝军教授、南京医科大学附属逸夫医院薛斌教授、南京大学医学院附属鼓楼医院孙喜太教授、南京大学方雷教授合作在Nature Communications杂志(影响因子11.878)上发表文章,报道了肝脏在应对脂质超负荷时通过细胞外囊泡调控脂肪重塑。
如果长期食用高脂饮食(HFD)、甘油三酯(TGs)首先会积聚在腹股沟白脂肪组织(iWAT)和附睾白脂肪组织(eWAT)中,并且由于异位脂质积累而导致肝脏脂肪变性。代谢组织之间的通讯调节了人体中TG的分布,这对于全身代谢稳态至关重要。当这些燃料存储器官中的脂质存储和清除平衡异常时,身体会遭受代谢异常,例如肥胖、糖尿病和高脂血症。
肝通过开窗的、不连续的内皮在餐后从肝窦中吸收乳糜微粒(CMs)和其它非脂质营养物质。膳食脂肪酸被转化为甘油三酯,并以脂质滴的形式储存在肝细胞中。多余的脂质被输出到血液中,然后储存在脂肪和其他组织中。因此,肝脏是多效性内分泌器官,首先获取营养,然后影响局部和远端器官的新陈代谢。先前的研究表明,肝脂肪含量是胰岛素抵抗的最强预测因子,通常先于其它异常的发展,包括脂肪细胞肥大和肥胖发展、脂肪细胞死亡、巨噬细胞浸润和脂肪炎症。几种肝因子,例如胎球蛋白A、adropin和成纤维细胞生长因子21(FGF21),调节胰岛素敏感性、目标器官(包括脂肪、骨骼和心脏)的炎症和生热作用。总的来说,肝脏在将代谢能传达给其它器官时,在代谢器官之间的代谢反应的相互作用中起着重要作用。但是,来自肝脏的细胞特异性信号调节其它器官的机制仍然未知。
最近,细胞外囊泡(EVs)已在代谢信号的器官与器官之间的交流中显示出明显的潜力,尤其是外泌体和微囊泡。显然,肝脏分泌的EV可能代表了一种将其货物蛋白或miRNA导向靶组织的特定策略,而其中的货物也以细胞依赖性的方式发挥作用。早期证据表明,从脂肪中释放出的EV可调节局部或远端代谢组织,包括内皮细胞、肝脏、骨骼肌和胰腺。肝脏产生的EV调节肿瘤的生长、病毒感染和肝细胞的再生。这项研究提供的证据表明,在脂质超负荷的情况下,肝EV可介导脂肪内的靶标通讯,从而促进肝脏与脂肪之间的多种相互串扰。
该研究报道了在短时间内喂食HFD的小鼠TGs首先在肝脏中积累,然后是脂肪。短期脂质超负荷引起肝EV刺激的脂肪成脂,而长期脂质超负荷引起脂肪形成。此现象在肝脏特异性EV分泌减少的肝脏特异性牻牛儿基牻牛儿基焦磷酸合成酶(Ggpps)敲除(LKO)小鼠模型中得到抑制。发现这是肝EV的组织靶向和代谢信号转导功能的作用,这取决于由GGPPS介导的Rab27A香叶基香叶基化作用介导的特定递送机制。此外,在脂肪过多的TG沉积的NAFLD患者的血浆中,几种源自EV的miRNA的水平升高,并且这种升高对应于体内和体外脂肪细胞TG沉积的增强。研究结果表明,肝脏通过包含miRNA的特定EV引导组织间与脂肪的串扰,从而具有至关重要的、活跃的代谢调节作用。总之,这种肝EV介导的肝脏-脂肪信号交流可能对脂肪代谢的适应性至关重要,以维持全身的稳态。
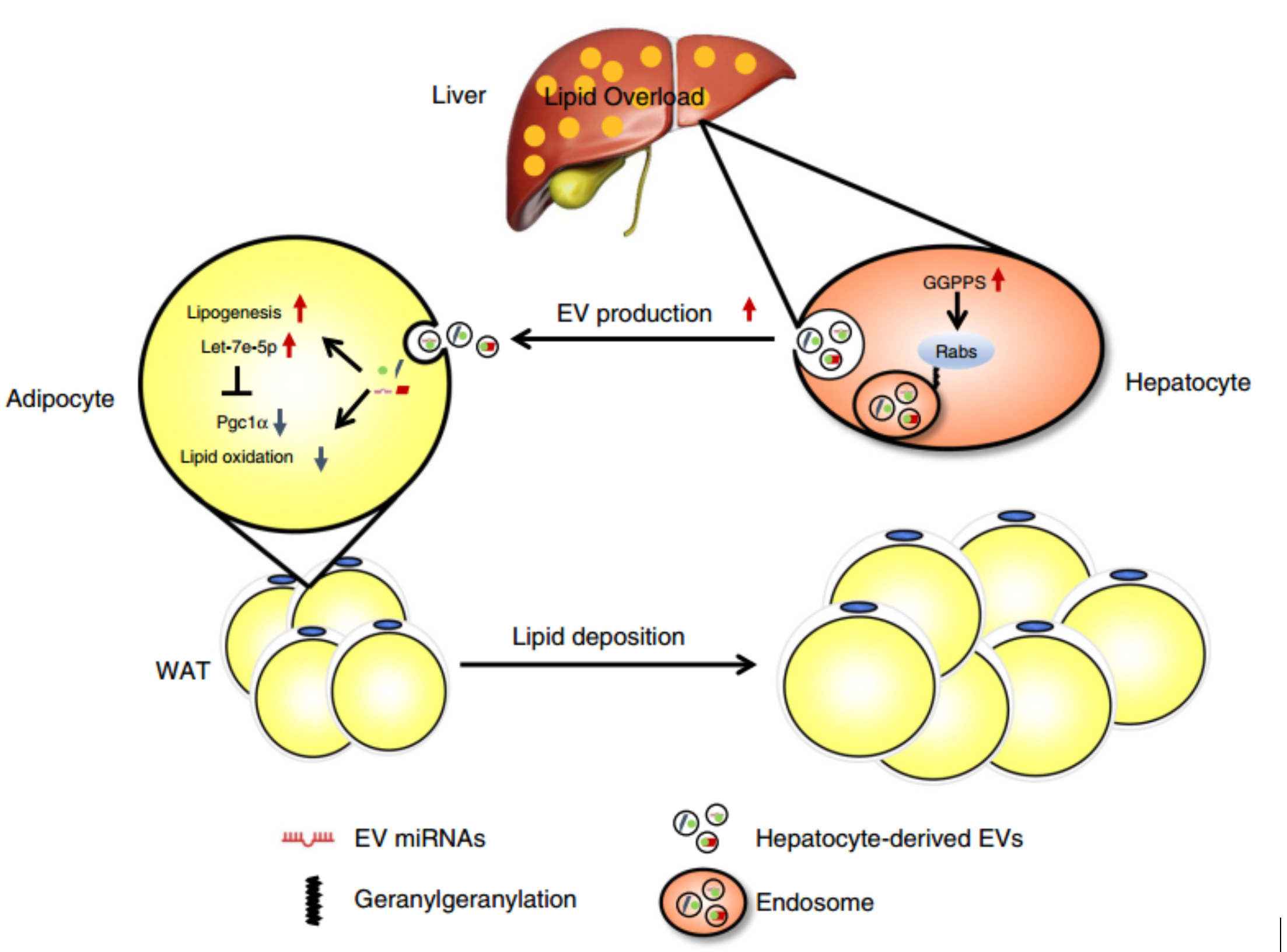
肝EV对脂肪重塑的作用示意图
参考文献:
Zhao Y, Zhao MF, Jiang S, et al. Liver governs adipose remodelling via extracellular vesicles in response to lipid overload. Nature Communications. 2020;11(1):719. Published 2020 Feb 5. doi:10.1038/s41467-020-14450-6
外泌体资讯网 Nature子刊:肝脏通过细胞外囊泡调控脂肪重塑




