由细胞外囊泡或外泌体转移的LMP1可以促进癌症进展。来自中南大学湘雅医院杨力芳课题组以及湖南大学李丹课题组的研究人员发现,细胞外囊泡包裹的LMP1通过NF-κB途径将正常成纤维细胞转换为肿瘤相关的成纤维细胞,并介导了成纤维细胞中从氧化磷酸化到糖酵解的代谢转换。该研究发表于Cancer Letters杂志上。
鼻咽癌(NPC)是中国南方常见的最具侵略性的头颈癌类型之一。爱泼斯坦-巴尔病毒(Epstein-Barr virus,EBV,人类疱疹病毒第四型)感染与NPC的发展高度相关。EBV编码的LMP1蛋白是一种不可或缺的膜蛋白,可在50%至80%的NPC样本中检测的到,并作为TNFR家族的模拟蛋白,从而激活NF-κB、MAPK/ERK,PI3K/Akt和JNK途径。LMP1还通过影响细胞增殖、抗凋亡、细胞迁移、侵袭和血管生成来调节一些有助于NPC发展的蛋白质。
越来越多的研究表明,肿瘤的进展不仅可能依赖于肿瘤细胞本身,还可能受到周围基质细胞的影响。肿瘤相关的成纤维细胞(CAF)是肿瘤周围基质的主要细胞类型,其特征在于表达α平滑肌肌动蛋白(α-SMA)和成纤维细胞活化蛋白(FAP)。CAF部分源自骨髓来源的祖细胞,但主要源自周围组织中的正常成纤维细胞(NFs)。据报道,包括TGF-β、PDGF和PI3K在内的几种细胞内信号传导途径可通过重新编程NF-κB、ERK、AKT信号传导途径来调节CAF的活性。CAF还可以调节特定的微环境,可促进肿瘤的生长、侵袭、转移和治疗耐受。肿瘤细胞与CAF之间的通讯已得到广泛研究,然而在NPC中,肿瘤细胞激活成纤维细胞的潜在机制仍不清楚。
细胞外囊泡(EVs)是源自多囊胞内体或多泡体(MVB)的微囊泡,当这些结构与质膜融合时就会分泌出来。根据大小不同,EV通常包括凋亡小体(500-1000 nm)、微泡(MVs,100-350 nm)和外泌体(30-150 nm)。TSG101、CD63、Hsp70和CD81等高表达蛋白通常被用作鉴定EV的标记物。EV介导细胞间的通讯并激活信号通路,将其中的内容物(例如蛋白质、核酸和脂质)从供体细胞传递到靶细胞。LMP1已被证明定位在高尔基体和MVB中,并包装到EV或外泌体中释放,而含LMP1的EV或外泌体则增强了NPC细胞的生长、迁移和侵袭,这证明了LMP1操纵肿瘤微环境的能力,增强EBV相关的癌症进展。
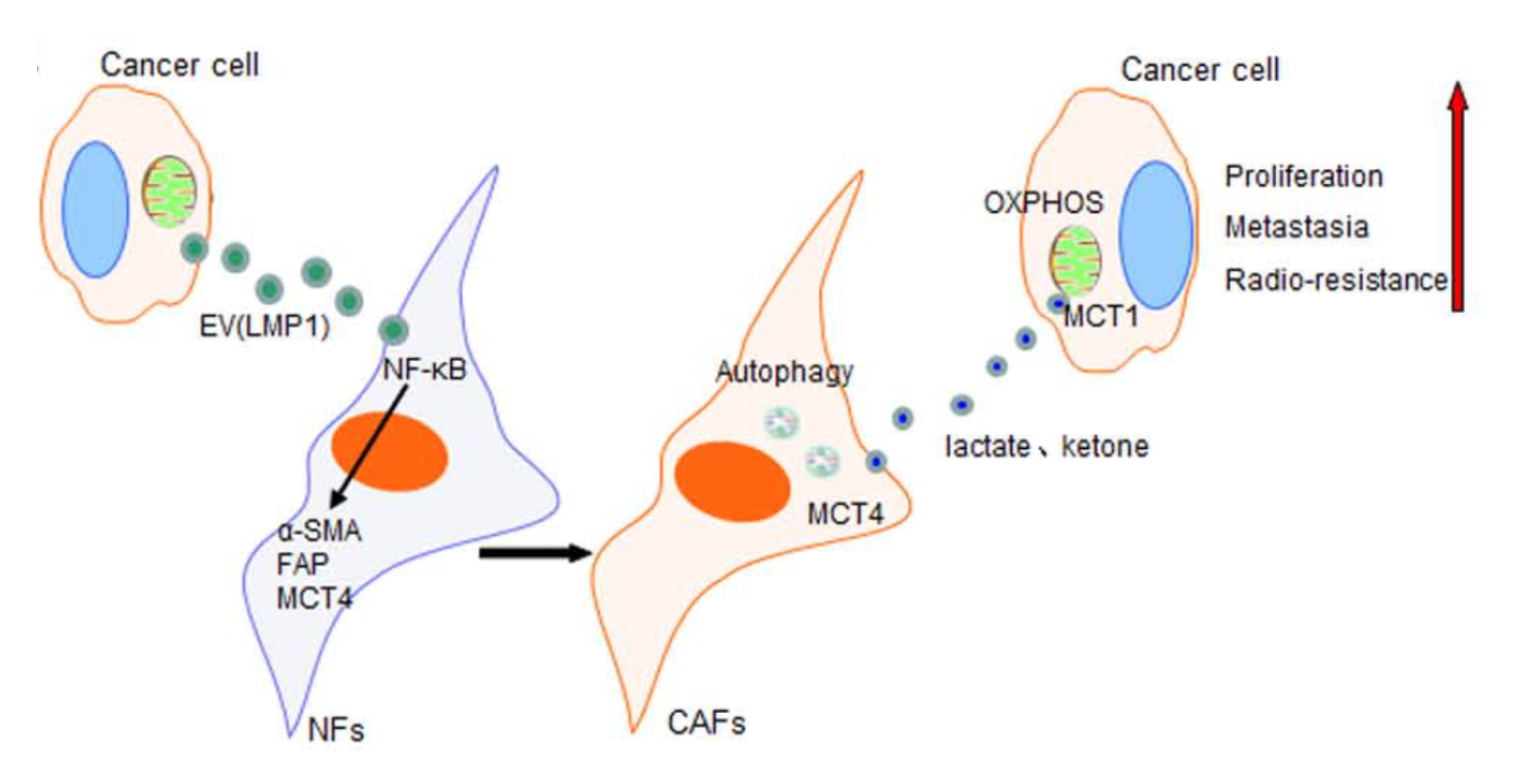
越来越多的证据表明,CAFs还可以分泌代谢产物来促进肿瘤细胞的生长。当成纤维细胞与肿瘤细胞共培养时,CAFs被迫进行有氧糖酵解并产生能量丰富的代谢物(例如乳酸和β-羟基丁酸酯),为肿瘤细胞的三羧酸循环和氧化磷酸化带来补充。研究人员将这种新现象称为“反向Warburg效应”(RWE)。当处于氧化应激或肿瘤诱导条件下时,CAFs的这种变化可能是由于自噬引起的,是一种有利于肿瘤细胞的现象。反向肿瘤Warburg代谢的特征是肿瘤细胞中MCT1的高表达和周围基质中MCT4的高表达。但是,激活的CAF通过这种方式调节肿瘤代谢从而影响肿瘤进展的机制尚不清楚。
在这项研究中,研究人员发现EV包装的LMP1可以将正常的成纤维细胞(NFs)激活为CAF。NF-κB p65途径是在NPC中促进NFs活化为CAFs的关键信号通路。在激活的CAF中,有氧糖酵解和自噬增加。而在肿瘤细胞中,葡萄糖的摄取和乳酸的产生减少,并且增强了肿瘤细胞中的线粒体活性,这支持了反向Warburg效应学说。在此过程中,研究人员观察到了CAF中MCT4和肿瘤细胞中MCT1的上调。NF-κB p65途径在MCT4的调控中也起着重要作用。此外,与CAF的共培养后,NPC细胞的增殖、迁移和放疗抗性增强。EV包装的LMP1通过体内激活CAF促进肿瘤增殖和转移前的微环境的形成。该研究验证了EV包裹的LMP1激活CAF并通过自噬和耦合基质-肿瘤代谢促进肿瘤进展。




