三阴性乳腺癌(TNBC)是所有乳腺癌中最具转移性和复发性的亚型,由于缺乏治疗靶标,化学疗法和外科手术干预是TNBC的仅有的治疗方法,但化学疗法的有效性低,受限于低靶向性高毒性等。来自上海市奉贤区中心医院(安徽理工大学附属奉贤医院、南方医科大学附属奉贤医院)冯景课题组的研究人员开发了用c-Met亲和肽修饰巨噬细胞来源的外泌体膜,并包被聚乳酸乙醇酸纳米载体,用于TNBC的靶向化疗。结果显示这种工程化改造的外泌体包被的纳米载体具有优异的肿瘤蓄积功效,并显著提高了化学治疗药物的抗肿瘤效率。该研究发表于Nanoscale杂志上。三阴性乳腺癌(TNBC)定义为雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子2(HER2)表达的缺失,是乳腺癌中最具侵袭性的亚型之一。TNBC占所有类型乳腺癌的15%-20%,并且比其他乳腺癌亚型表现出更强的转移性和更差的预后。由于治疗靶标的缺失,TNBC对于激素治疗和HER2靶向治疗均无效。阿霉素(DOX)和紫杉醇是用于临床TNBC治疗的常用化疗药物。但是,它们的治疗效果受到一些缺点的限制,例如低水溶性、体内快速清除、不良的肿瘤靶向性以及对正常组织的高毒性。在过去的十年中,由于合成药物递送系统在药物递送中的稳定性和有效性,科学家们做了很多努力去开发合成药物递送系统。然而,这些系统作为非自体成分,通常难以构建,并且会表现出一些问题,例如生物毒性和免疫活化下的快速清除。因此,迫切需要设计良好、高效和低副作用的药物输送系统来改善TNBC的治疗效果。近年来,外泌体已成为治疗癌症的非常流行的药物传递载体。外泌体是直径为40-200 nm的细胞外囊泡,几乎被所有类型的细胞释放。外泌体包含多种核酸和蛋白质,并在细胞通讯中起重要作用。外泌体膜包含各种具有特定功能的膜蛋白。例如,CD9和CD81帮助外泌体和受体细胞融合,CD55和CD59可以抑制补体攻击,而CD47使外泌体免受巨噬细胞识别和吞噬作用。另外,由于外泌体是在体内形成的,因此它们是天然的无毒性的,具有高度生物相容性并表现出长的血液循环时间。这些独特的功能使外泌体成为封装药物用于TNBC治疗的出色纳米载体。 外泌体由于其特定的膜蛋白(如四次跨膜蛋白和整联蛋白)而具有内在的细胞靶向特性。例如,在外泌体表面上整合素α4β1的使外泌体与肿瘤细胞上过表达的血管细胞粘附分子1相结合。此外,外泌体的靶向能力可以通过对表面分子进行工程化而增强。间充质-上皮转化因子(c-Met)是属于肝细胞生长因子中的一种酪氨酸激酶受体,在促进上皮间质转化、血管再生和细胞增殖中发挥作用。c-Met与肝细胞生长因子之间的相互作用在血管生成、细胞存活和转移中起着重要作用。先前的研究报道c-Met在TNBC中高度过表达。c-Met信号异常会导致肿瘤患者预后不良、转移发生频率增加和耐药性升高。由于c-Met在TNBC细胞表面的过表达,c-Met有潜力作为TNBC抗肿瘤药物递送的理想靶标。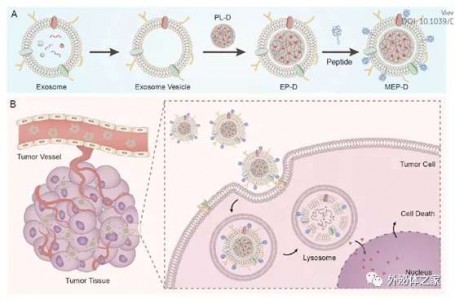
研究示意图
在本研究中,研究人员使用工程化的外泌体膜包被的纳米颗粒制备了c-Met靶向药物递送系统MEP-D,实现了TNBC的靶向化疗,如示意图所示。载有DOX的聚乳酸乙醇酸共聚物(PLGA)纳米颗粒被包装到巨噬细胞来源的外泌体中。而巨噬细胞外泌体本身具有将miRNA或蛋白质转移到肿瘤细胞中,发挥调节作用,例如调节对化学疗法的抗性并促进细胞侵袭。在这项工作中,研究人员首先去除了巨噬细胞外泌体中的核酸蛋白质等内容物,并将外泌体膜包被在PLGA纳米颗粒上,以利用巨噬细胞外泌体膜的固有肿瘤靶向特性。为了进一步增强肿瘤靶向能力,将与TNBC中过度表达的c-Met表现出高亲和力的c-Met结合肽固定在外泌体包被的纳米载体的表面。研究人员在体外和体内均评估了MEP-D的生物安全性、肿瘤蓄积性和抗肿瘤效率。结果表明,经工程改造的外泌体涂层纳米颗粒可显著提高细胞的吸收效率和阿霉素的抗肿瘤功效。体内研究表明,该纳米载体表现出显著的肿瘤靶向功效,肿瘤生长抑制作用增加并能大幅度诱导肿瘤细胞凋亡。这些结果表明,工程化的巨噬细胞外泌体包被的纳米颗粒是用于TNBC治疗的有前途的药物递送策略。参考文献:Li S, WuY, Ding F, Yang J, Li J, Gao X, Zhang C, Feng J. Engineering macrophage-derivedexosomes for targeted chemotherapy of triple-negative breastcancer. Nanoscale.2020 May 12. [Epub ahead of print]
外泌体资讯网 上海市奉贤区中心医院:工程化的巨噬细胞来源的外泌体用于三阴性乳腺癌的靶向治






