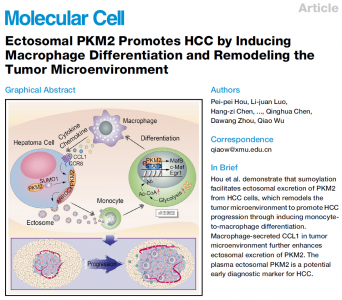
肿瘤来源的细胞外囊泡是肿瘤发生过程中细胞间通讯的重要介质。近日,来自厦门大学生命科学学院吴乔教授课题组的研究人员在Molecular Cell杂志上发表文章,证明了肝细胞癌衍生的微囊泡重塑了肿瘤微环境及其发生的机制,并揭示了微囊泡PKM2通过重塑肿瘤微环境从而促进了肝癌的进展,有望成为新的肝癌诊断标志物。
肝细胞癌(HCC)是最常见的原发性肝癌,是全球癌症相关死亡的主要原因之一。我们知道,肿瘤在支持性肿瘤微环境(TME)中发展,这些微环境成分彼此持续相互作用帮助HCC进展。 TME的结构由浸润肿瘤的单核细胞/巨噬细胞、免疫抑制细胞、成纤维细胞、脉管系统和分泌的炎症因子组成。在这种复杂且相互联系的环境中,HCC细胞与相邻的基质细胞相互作用并帮助基质细胞生长发育,这使得靶向这些基质成分进行肿瘤治疗、或者阻断HCC细胞与相关基质细胞之间的相互联系可以成为HCC的治疗策略。
肿瘤浸润巨噬细胞是HCC肿瘤微环境中最丰富的基质细胞类型之一,不仅通过诱导细胞外基质重塑、血管生成、肿瘤转移和治疗耐药从而抑制抗肿瘤免疫,而且还分泌各种炎症介质促进肿瘤细胞的进展。这些巨噬细胞主要来自循环里的单核细胞前体,被来自肿瘤细胞的调节因子的刺激而分化成为成熟的巨噬细胞。据报道包括MafB、c-Maf、Egr-1、Klf4和PU.1在内的转录因子可以介导和限制巨噬细胞的分化过程,但是,对这个过程的详细机制仍然知之甚少。
最近报道,肿瘤来源的细胞外囊泡(EVs),特别是外泌体,对于肿瘤发展过程中的细胞间通讯至关重要。例如,含有miR-1247-3p的HCC细胞来源的外泌体可被成纤维细胞吸收,并将普通成纤维细胞转化为肿瘤相关的成纤维细胞,从而进一步促进肝癌的肺转移。微囊泡(ectosomes)比外泌体要大得多(外泌体的直径为40-150 nm,而微囊泡的直径为150-1,000 nm),是直接从质膜脱落的EV的一种亚型。尽管外泌体和微囊泡之间存在相当大的差异,但是它们在细胞间调节中的功能被认为在很大程度上是相似的。
糖酵解通常在肿瘤细胞中过度活跃,以满足合成代谢的需求并维持体内稳态以适应各种压力。丙酮酸激酶M2同工型(PKM2)催化糖酵解的最后一步不可逆的步骤,并在肿瘤细胞中高度表达。现有的研究表明,PKM2通过其在细胞质中固有的较低的丙酮酸激酶活性来促进肿瘤合成代谢、存活和增殖。更重要的是,PKM2在细胞核中还表现出独特的非代谢作用,作为激活基因表达的蛋白激酶或转录共激活因子,从而促进肿瘤的进展。但是,细胞外PKM2的生物学功能仍在研究当中。
在这项研究中,研究人员发现了一个新的途径,该途径通过HCC细胞与单核细胞/巨噬细胞之间的微囊泡介导的细胞间通讯来促进HCC的发展。HCC细胞来源的微囊泡诱导了单核细胞分化为肿瘤浸润的巨噬细胞,呈PKM2依赖性,从而促进了HCC的发展。源自HCC的微囊泡PKM2不仅诱导单核细胞的代谢重编程,而且诱导细胞核中的STAT3磷酸化,从而上调分化相关的转录因子,从而导致单核细胞向巨噬细胞的分化和肿瘤微环境的重塑。在HCC细胞中,PKM2的SUMO化通过与ARRDC1的相互作用诱导其靶向质膜,导致其以ARRDC1依赖的方式进入微囊泡,并向细胞外分泌。在HCC细胞中,巨噬细胞分泌的细胞因子/趋化因子以CCL1-CCR8轴依赖性方式增强了HCC中的PKM2-ARRDC1相互作用,进一步促进了HCC细胞中PKM2的向外分泌,从而形成了肿瘤形成的前馈调控环路。在临床实验中,研究人员在肝癌患者血浆中检测到了微囊泡PKM2。总之,这些结果揭示了微囊泡PKM2在HCC进程中的新生过程,可作为有希望的临床诊断标志物和治疗靶标。
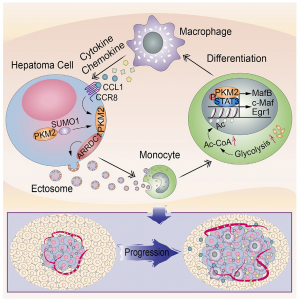
该研究的模式图
参考文献:Hou PP, Luo LJ, Chen HZ, et al.Ectosomal PKM2 Promotes HCC by Inducing Macrophage Differentiation andRemodeling the Tumor Microenvironment. Mol Cell. [published online ahead ofprint, 2020 May 20]