衍生自各种生物流体的外泌体可以作为癌症早期检测的潜在生物标记物,然而由于缺乏可靠的分离和检测方法,外泌体临床转化仍然具有挑战性。近日,来自温州医科大学眼视光学院、生物医学工程学院刘飞、Qingfu Zhu课题组的研究人员开发了一种新型的集成微流控装置,该装置能够从肺癌患者的尿液中高灵敏度和特异性分离并原位检测肺癌特异性外泌体。该研究发表于Biosensors and Bioelectronics杂志上。
非小细胞肺癌(NSCLC)是最常见的肺癌类型,约占所有肺癌的85%。在目前,低剂量电脑断层摄影术(LDCT)和放射线摄影术被认为是诊断肺癌的标准方法,通过这些方法可以实现降低肺癌死亡率。但是,这两种影像学检测的假阳性率也很高。在过去的几年,追踪血液、痰液和尿液等体液中的分子标记物已开始用于NSCLC的早期检测。例如,细胞外囊泡(EVs),尤其是外泌体,已成为一种潜在的新型生物标志物,可用于肺癌的早期诊断和治疗监测。外泌体通常通过内溶酶体途径从多囊体中释放出来,大小通常为30-150 nm。外泌体携带来自其亲代细胞的大量大分子,例如跨膜蛋白(CD63、CD81、CD9等)和胞质蛋白、不同类型的RNA等,可用作检测细胞行为变化的生物标志物,尤其是那些与恶性行为相关的生物标志物。目前,超速离心(UC)被认为是分离外泌体的金标准。高离心力(120,000g)通常用于分离纳米级的外泌体。但是,UC法通常需要较长的处理时间,且产品回收率低。此外,高剪切力可能会损坏囊泡的膜。免疫分离法是分离外泌体的另一种选择。但是它的捕获效率高度依赖于外泌体表面上靶蛋白的存在,这可能会导致产物得率低下,并导致未富集靶蛋白的囊泡的信息丢失。近年来,基于尺寸排阻的分离技术由于其高分离效率而受到越来越多的关注。通常,根据不同的尺寸,可以选择具有确定的分子量或大小限制的纳米膜分离外泌体。在外泌体分离过程中,通常使用光学和非光学方法来获取外泌体的大小、浓度和形态等信息。但是,这些方法无法去量化患者样品中外泌体标记物的水平。尽管可以通过PCR和琼脂糖凝胶电泳测量外泌体RNA(例如microRNA和mRNA)的水平,但是在分析之前必须先裂解外泌体,这就增加了测试的复杂性。外泌体蛋白也是外泌体表征的典型标记物,通常通过免疫亲和方法(例如酶联免疫吸附测定ELISA和蛋白质印迹)进行检测。然而,这些方法处理时间长并且需要手动的工作流程。 等离子体共振瑞利散射光谱法和暗场显微镜(DFM)可以用于量化和无标记检测肿瘤来源的外泌体。当多个等离子体纳米粒子非常接近时,其等离子体振荡耦合在一起,从而导致光散射强度以及光谱红移显著增加。在这项研究中,研究人员开发了一种新型的集成微流控装置,该装置可以实现从患者尿液中收集的肺癌特异性外泌体的分离和原位检测。该新装置是使用聚甲基丙烯酸甲酯(PMMA)和经过捕获抗体修饰的纳米多孔金纳米簇膜(AuNC)制造的,然后装载第二抗体偶联的金纳米棒探针(AuR),通过暗视野显微镜鉴定并量化肺癌特异性外泌体。由于共振瑞利散射,AuNC-外泌体-AuR复合物产生了显著的散射波长偏移,并提高了散射强度,这使LOD低于1000颗粒/ mL的外泌体可以实现超灵敏检测。蛋白质组学分析表明,该装置可以分离出高纯度的外泌体。然后,研究人员用来自肺癌患者和健康对照组的500μL尿液样品验证了该方法,这表明该方法有希望将早期肺癌患者与健康个体区分开来。综上所述,该方法快速且超灵敏的,并且可以容易地适用于从其他恶性肿瘤分离和检测癌症特异性外泌体。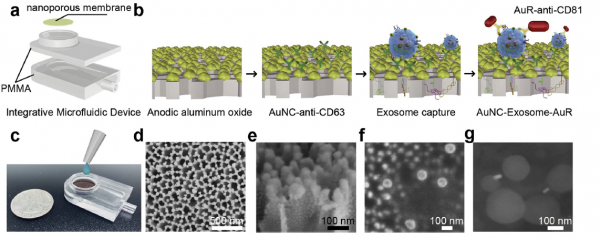
参考文献:Yang Q, Cheng L, Hu L, et al. Anintegrative microfluidic device for isolation and ultrasensitive detection of lung cancer-specific exosomes from patient urine. Biosens Bioelectron. 2020; 163:112290.外泌体资讯网 温州医科大学:一种用于从尿液中分离和检测肺癌特异性外泌体的微流控装置



