来自法国的研究人员在Circulation Research杂志上发表文章,报道了由代谢综合征患者的大细胞外囊泡(MetS-1EV)携带的Rap1参与促进平滑肌细胞(SMC)的增殖、迁移、促炎性特征以及ERK5/p38途径的激活,从而导致血管炎症和重塑以及动脉粥样硬化。由MetS-1EV携带的Rap1可能是对心血管代谢危险因素诊断价值的新决定因素,并表明Rap1是对抗动脉粥样硬化发展的有希望的治疗靶标。
代谢综合征(MetS)患者患动脉粥样硬化性心血管疾病的风险大约增加了两倍。该综合征被描述为腹部肥胖、胰岛素抵抗、高血压(BP)和与肥胖相关的血脂异常,包括低水平的HDL-胆固醇和高水平的甘油三酸酯。在动脉粥样硬化的早期,典型的人类动脉粥样硬化病变包含不同的细胞类型,包括与炎症反应和斑块形成有关的血管平滑肌细胞(SMC)、内皮细胞、成纤维细胞、巨噬细胞和泡沫细胞。血管SMC从中膜介质向内皮下区域的增殖和迁移,也称为新内膜形成,在血管重塑中起关键作用,血管重塑是血管增厚和闭塞的关键步骤。近年来,研究发现细胞外囊泡(EV)与动脉粥样硬化病变发展的早期过程相关,包括内皮功能障碍、炎症、活性氧产生和单核细胞/巨噬细胞粘附。主要探究了两个EV亚型:从细胞膜起泡释放的大EV(lEV)和在多囊泡内体区室中产生的小EV(sEV)。研究表明,动脉粥样硬化患者的泡沫细胞源EV通过调节肌动蛋白的细胞骨架和黏着斑途径,从而促进SMC的迁移和粘附,这些内在作用是将EV内吞到SMC中,随后激活下游的ERK和Akt。关于MetS,该团队报道携带Fas配体的MetS患者的lEV(MetS-1EV)通过与内皮细胞上的Fas受体相互作用诱导内皮功能障碍。导致内质网与线粒体之间发生短暂的串扰,通过中性鞘磷脂酶的激活和一氧化氮(NO)的释放增加了细胞质和线粒体产生的活性氧。此外,循环的MetS-1EVs引起了氧化应激和促炎分子(例如单核细胞趋化蛋白-1(MCP-1)和诱导型一氧化氮合酶)的过度表达。然而,循环MetS-1EV对SMC的早期动脉粥样硬化的作用尚未见充分阐明。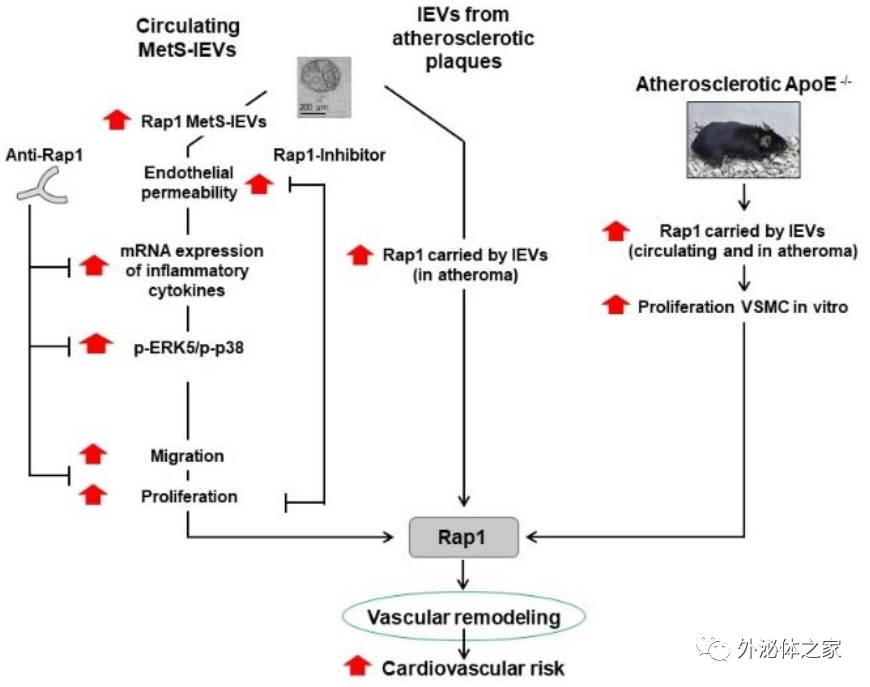
在该研究中,蛋白质组学分析表明,MetS-lEV中Rap1增加了>1.4倍,携带Rap1的lEV在体外诱导了主动脉SMC的迁移和增殖以及促炎性细胞因子的分泌。当lEV携带的Rap1被中和或药理抑制时,所有这些作用都将被消除。携带Rap1的lEV的水平与腰围和臀围、体重指数(BMI)、甘油三酯血症、胰岛素血症、高敏感性C反应蛋白(hs-CRP)和MetS患者狭窄风险增加相关。这些结果表明,lEV携带的Rap1对于与MetS相关的动脉粥样硬化的发展至关重要。高脂饮食(HFD)喂养的ApoE-/-小鼠在循环的lEV中显示Rap1的表达增加,这也增强了SMC的增殖。另外,来自鼠和人动脉粥样斑块的lEVs在Rap1中富集。总之,该研究提出过量产生的Rap1+-lEVs是引起MetS的血管重塑和炎症导致动脉粥样硬化进展的原因。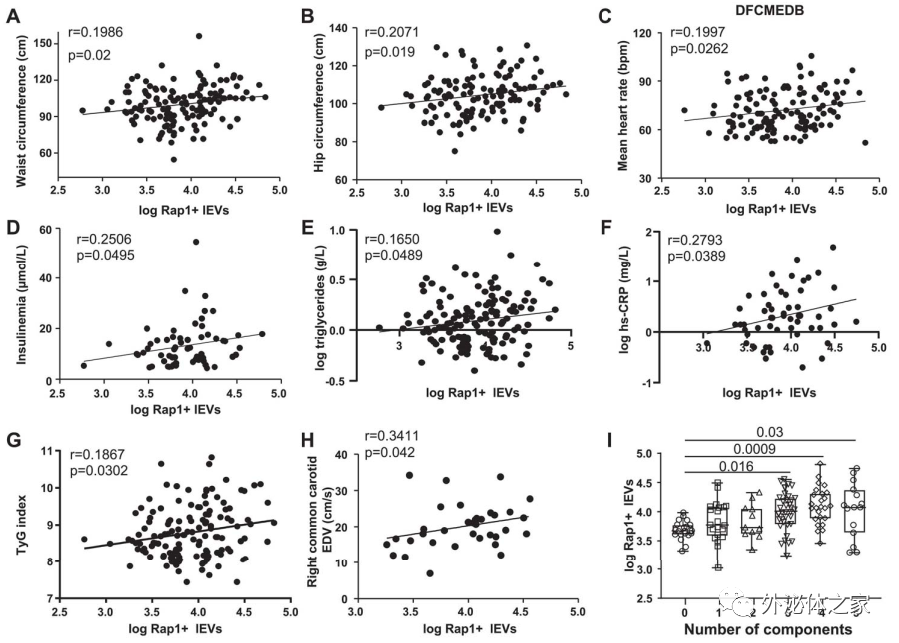
Rap1-lEVs的循环水平与在非代谢(nMetS)和代谢综合征(MetS)受试者中观察到的与临床指征之间的相关性LargeExtracellular Vesicle-Associated Rap1 Accumulates in Atherosclerotic Plaques,Correlates with Vascular Risks and Is Involved in Atherosclerosis. CirculationResearch. 2020 Jun 16. doi: 10.1161/CIRCRESAHA.120.317086. Onlineahead of print.外泌体资讯网 Circ Res:大细胞外囊泡相关的Rap1参与动脉粥样硬化,或可用于诊断和治疗靶标