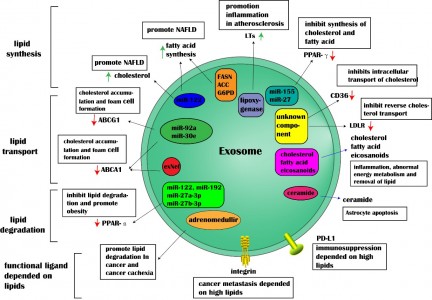
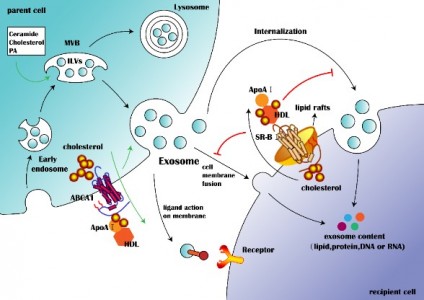
外泌体是由活细胞分泌的一种细胞外囊泡,直径在30~100nm之间,具有运输亲本细胞脂质、蛋白质以及核酸分子并参与受体细胞内遗传信息表达以及代谢过程(如图1)。来自湖南中医药大学廖端芳、覃丽教授团队在Cell Communication and Signaling杂志上发表文章The crosstalk: exosomes and lipid metabolism,阐述外泌体介导的脂质代谢在疾病发展中的作用。外泌体一个完整的生命历程包括早期内涵体形成、成熟多泡体形成、外泌体的分泌以及受体细胞摄取外泌体。但是,外泌体的这些生物现象与脂质、脂质转运体以及脂质代谢酶类密切相关。从早期内涵体发育到成熟多泡体的过程,需要大量的胆固醇、磷脂以及鞘磷脂等,是外泌体磷脂双分子层形成的关键物质。ABCA1介导的细胞胆固醇流出可促进外泌体的分泌,然而SR-B1介导的胆固醇流出却会抑制外泌体被受体细胞摄取(如图2)。这些提示外泌体的生物活动是与脂质代谢(运动)密切相关,疾病进展中强化的脂质代谢(紊乱)可促进外泌体的分泌,反过来外泌体又可促进疾病进展。而这正是脂质代谢紊乱在动脉粥样硬化、部分肿瘤、肥胖以及阿尔兹海默症等疾病发生发展进程的关键机制。动脉粥样硬化是大多数心血管疾病的病理基础,它与动脉内膜中异常胆固醇的积累密切相关。外泌体中的循环miRNA(如miR-30e与miR-92a),可通过与3'UTR mRNA直接结合而抑制胆固醇转运蛋白的表达。从活化的人类CD4+ T细胞上清液中分离出的外泌体能够产生促炎性细胞因子TNF-,诱导巨噬细胞中胆固醇的积累。另外,外泌体还可以诱导白三烯(LTs)的生物合成,白三烯是有效的促炎脂质中介体。巨噬细胞和树突状细胞(DC)的外泌体含有功能性酶,用于LTs的生物合成,并导致中性粒细胞在动脉粥样硬化期间释放趋化因子到内皮细胞,致使内皮功能障碍加重、以及单核细胞在易损血管壁中积聚。肿瘤细胞在低氧的微环境中更容易产生和分泌外泌体,由于过量的缺氧诱导因子-1α(HIF-1α)调节小GTPaseRab27a(外泌体合成的主要调节因子)的激活。肿瘤相关巨噬细胞来源的外泌体中的HIF-1α稳定长非编码RNA(HISLA)通过脯氨酸羟化酶结构域2(PHD2)和HIF-1α稳定HIF-1α。高脂环境更有利于正常细胞吸收源自癌症的外泌体,并诱导正常细胞转化为癌细胞。外泌体携带的生物活性脂质(如PGE2α、PGE1、PGE2等),可从巨噬细胞释放到癌症微环境中,维持肿瘤微环境的炎症状态。另外,肿瘤的免疫抑制、侵袭与转移、耐药等也与外泌体的高胆固醇密切相关。肥胖与脂肪组织或脂肪组织相关细胞(如巨噬细胞)的代谢状态密切相关。巨噬细胞分泌含miR-155的外泌体并将其移至脂肪细胞,其中miR-155通过下调其靶基因PPAR-γ抑制肥胖。此外,外泌体中的循环miRNA(如miR-122、miR-192、miR-27a-3p和miR-27b-3p)也可以抑制白色脂肪组织中PPAR-α的表达。从机制上讲,来源于间充质干细胞的外泌体miR-124a可使巨噬细胞中的FOXA2沉默,从而导致细胞内脂质蓄积及代谢紊乱。阿尔茨海默氏是一种神经退行性疾病,Aβ肽形成的淀粉样斑块在细胞外沉积是其重要发病机制之一。但是, Aβ附着于星形胶质细胞来源的外泌体表面,降低Aβ的积累。除此之外,星形胶质细胞来源的外泌体携带神经酰胺,其累积导致了神经元凋亡。另外,在外泌体中检测到中性鞘磷脂酶的过表达,并且它们能够催化神经酰胺的产生,导致神经元的凋亡。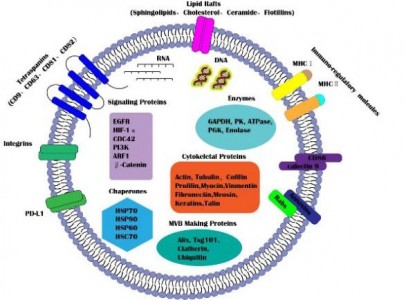
Wang W, Zhu N, Yan T, Shi YN, Chen J, Zhang CJ, Xie XJ, Liao DF,Qin L. Thecrosstalk: exosomes and lipid metabolism. Cell Commun Signal. 2020 Aug3;18(1):119. doi: 10.1186/s12964-020-00581-2.外泌体资讯网 湖南中医药大学:外泌体与脂代谢【综述】