基因异常表达及突变引起的疾病往往不能够被传统药物所治愈,有效的基因表达干预成为治疗这类疾病的唯一方法。RNA干扰(RNAi)现象被发现之后,该技术迅速被科研人员应用于疾病治疗领域,使基因治疗的发展迎来了巨大的契机。该技术通过导入小干扰RNA(siRNA)特异性抑制致病靶向基因的表达,起到治疗疾病的作用。遗憾的是,虽然RNAi技术让人们看到了基因治疗的曙光,但是siRNA的体内递送问题一直阻碍着RNAi技术的临床应用。如何让siRNA在体内稳定传输,能否找到一种安全、可靠、与机体高度兼容的递送载体,一直是RNAi转化应用的核心科学问题。
南京大学张辰宇团队的前期研究发现,细胞可以包裹小RNA(miRNA和siRNA)到外泌体并将外泌体分泌到细胞外;分泌的小RNA随后会被受体细胞摄取,调节受体细胞中的基因表达。由于外泌体是细胞自身分泌的囊泡,与其他载体相比,其具有低免疫源性和低毒性的特点,是一种良好的小RNA天然载体。因此很多研究人员迅速开始着手尝试利用外泌体递送siRNA。在传统的基于外泌体的siRNA递送策略中,siRNA需要在体外细胞培养环境与外泌体进行预组装,然后通过超速离心等技术从培液上清中分离纯化细胞分泌的、包裹好siRNA的外泌体,从而得到外泌体siRNA并进行体内注射。该方法成本较高,过程复杂不易控制,分离得到的外泌体难以达到临床需求,限制了其大规模实际应用。
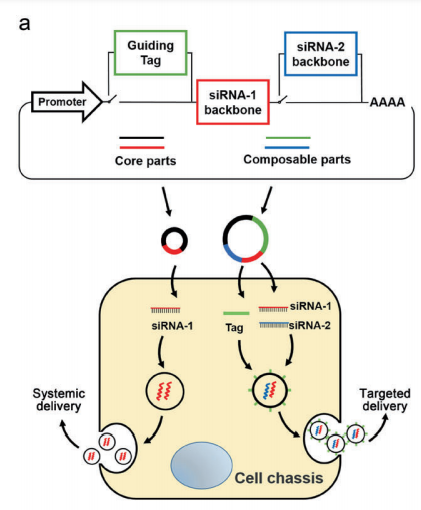
2020年3月29日,南京大学张辰宇团队在Cell Research 发表论文“In vivo self-assembled small RNAs as a new generation of RNAi therapeutics”,建立了新一代的siRNA递送及基因治疗技术,基于体内自组装外泌体siRNA的策略,实现siRNA从表达到装载再到递送的全体内自动化过程。该技术利用合成生物学设计理念,通过向小鼠静脉注射可表达siRNA和外泌体膜表面靶向肽段的合成生物学基因环路(以质粒DNA的形式),将小鼠的肝脏重构成可以产生和分泌siRNA的器官,继而利用机体自身的外泌体体内传输途径,实现siRNA在体内稳定、高效、安全的传输。利用该策略,研究人员成功实现了对肺癌、胶质母细胞瘤和肥胖三种疾病的靶基因干预,达到了显著的治疗效果。