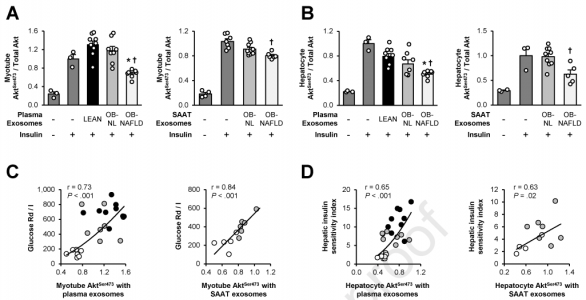
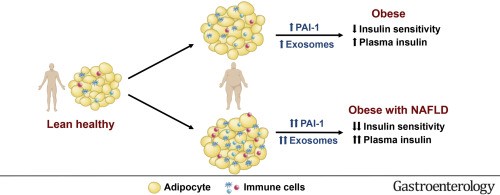
近日,Gastroenterology杂志上发表一篇文章,报道了肥胖和非酒精性脂肪肝患者的脂肪组织免疫学、炎症和外泌体与胰岛素敏感性之间的关联。肝脂肪变性是非酒精性脂肪肝疾病(NAFLD)的标志性特征,并且通常发生在肥胖人群中。肥胖诱导的胰岛素抵抗与NAFLD的发病机制有关,没有显著胰岛素抵抗的肥胖人群不太可能发生肝脂肪变性。即使具有patatin-like磷脂酶结构域3基因(PNPLA3)的遗传变异的人,虽然也显著增加了NAFLD的风险,但在没有肥胖症和伴随胰岛素抵抗的情况下,也不太可能发生肝脂肪变性。提高胰岛素敏感性对IHTG含量和NAFLD其他组织学特征的药理作用,为胰岛素抵抗在NAFLD发病机理中的作用提供了进一步的支持。这些发现强调了理解负责肥胖和NAFLD患者的胰岛素抵抗潜在机制的重要性。有人提出,脂肪组织(AT)促炎性免疫细胞和炎症的增加,增加了AT引起的炎性细胞因子向血液中的分泌,是肥胖引起人胰岛素抵抗的重要原因。在啮齿动物模型中,肥胖和胰岛素抵抗与脂肪组织巨噬细胞(ATM)和T细胞含量以及促炎性细胞因子的AT基因表达增加有关。实验上减少或完全消除了TNF-α信号或更高比例的抗炎症细胞促进葡萄糖耐量并改善胰岛素敏感性。然而,由于研究之间存在相互矛盾的数据,AT炎症在引起肥胖症患者胰岛素抵抗中的重要性尚不明确。研究发现,肥胖症患者的皮下腹部AT(SAAT)中促炎性巨噬细胞和CD4 T细胞增多。与胰岛素敏感者相比,被认为具有胰岛素抵抗性,而其他研究发现,胰岛素敏感性和胰岛素抵抗性人群之间没有差异。研究之间发现差异的原因可能与用于评估AT炎症和免疫细胞含量的方法的差异以及用于定义胰岛素敏感性和胰岛素抵抗性人群的标准的差异有关。外泌体是膜结合的细胞外囊泡,由体内大多数细胞产生,并通过将microRNA(miRNA)、生物活性脂质和调节蛋白从一个细胞传递到另一个细胞,提供了器官间通讯的机制。在啮齿动物模型中的研究数据已经显示出来自AT explants和ATMs的外泌体可以调节由特定miRNA的转移介导的全身性胰岛素作用。脂肪组织是循环外泌体中miRNA的主要来源。小鼠中Dicer的脂肪组织特异性敲除会导致循环中的外泌体miRNA减少四倍以上。因此,AT衍生的外泌体可能导致肥胖和NAFLD患者的全身胰岛素抵抗。背景与目的:胰岛素抵抗是NAFLD发病的关键因素。该研究评估了皮下腹部脂肪组织(SAAT)炎症以及血浆和SAAT衍生的外泌体在调节肥胖症和NAFLD患者胰岛素敏感性中的重要性。方法:评估脂肪组织炎症(巨噬细胞和T细胞含量以及促炎细胞因子的表达)、肝脏和全身胰岛素敏感性(通过高胰岛素-正常血糖钳和葡萄糖示踪剂评估)。在由脂肪和肝内甘油三酸酯(IHTG)含量分层的三组中24小时连续血浆细胞因子浓度:1)瘦者,具有正常的IHTG含量(LEAN; n = 14);2)IHTG含量的正常肥胖者(OB-NL; n = 28);3)患有NAFLD的肥胖者(OB-NAFLD;n = 28)。在部分参与者中评估了血浆和SAAT衍生的外泌体对人骨骼肌肌管和小鼠原代肝细胞中胰岛素刺激的Akt磷酸化的影响。结果:与OB-NL和LEAN组相比,OB-NAFLD中SAAT中的促炎性巨噬细胞、促炎性CD4和CD8 T细胞群体以及几种细胞因子的基因表达更高。但是,除了PAI-1(OB-NAFLD组中的LAI和OB-NL组中的PAI-1较大)外,两组之间的24小时血浆细胞因子浓度曲线下面积(AUC)没有差异。促炎巨噬细胞的百分比和血浆PAI-1浓度AUC与肝脏和全身胰岛素敏感性呈负相关。与来自OB-NL参与者的外泌体相比,来自OB-NAFLD组的血浆和SAAT衍生的外泌体减少了肌管和肝细胞中的胰岛素信号传导。结论:肥胖和NAFLD患者的全身胰岛素抵抗与血浆PAI-1浓度升高以及血浆和SAAT衍生的外泌体有关。临床试验编号:NCT02706262。FuchsA, Samovski D, Smith GI, Cifarelli V, Farabi SS, Yoshino J, Pietka T, Chang SW,Ghosh S, Myckatyn TM, Klein S. Associations among adipose tissue immunology,inflammation and exosomes and insulin sensitivity in people with obesity andnonalcoholic fatty liver disease. Gastroenterology.2021 May 15:S0016-5085(21)02978-4. PMID: 34004161.外泌体资讯网 Gastroenterology:外泌体参与肥胖/非酒精性脂肪肝患者的胰岛素敏感性