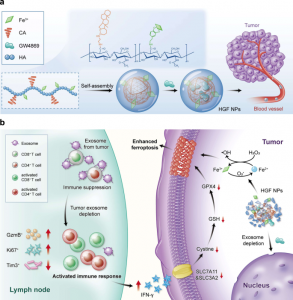
除了增加PD-L1的表达外,肿瘤细胞还可以分泌外泌体PD-L1来抑制T细胞活性。外泌体PD-L1 抵抗免疫检查点阻断,引起了治疗抵抗,抑制肿瘤来源的外泌体的分泌可能有助于更好的肿瘤治疗。来自澳门大学代云路课题组的研究人员在Nature Communications杂志上发表文章,他们开发了外泌体抑制剂(GW4869) 和铁死亡诱导剂 (Fe3+) 的组装纳米单元,诱导对黑色素瘤细胞的抗肿瘤免疫反应,并刺激细胞毒性T淋巴细胞和免疫记忆。这种新的纳米单元增强了对 PD-L1 检查点阻断的反应,并可能成为增强免疫疗法的治疗策略。 肿瘤细胞可以引起全身性免疫改变,帮助肿瘤细胞进行快速扩张。最近的研究发现,肿瘤细胞除了上调细胞表面程序性死亡配体 1(PD-L1)的表达外,肿瘤细胞(例如黑色素瘤)的外泌体上分泌高水平的 PD-L1,而外泌体是来自细胞内吞途径的一种特殊形式的细胞外囊泡,可干扰全身免疫状态。外泌体 PD-L1 可以进入引流淋巴结并以免疫抑制方式抑制 T 细胞活性。外泌体的这种作用方式可能解释了外泌体 PD-L1介导了PD-L1/PD-1 免疫检查点阻断疗法的耐药性,并与很大比例的相关临床治疗失败相关。下调这些外泌体的分泌,可以通过恢复和促进功能性 T 细胞增殖来缓解淋巴结衰竭,从而提高免疫疗法的抗肿瘤效率。铁死亡通常伴随着细胞内铁的丰富积累和氧化性羟基自由基的产生,损害细胞对脂质过氧化的抗氧化能力。这种氧化性细胞死亡已被证明与多种治疗方案相关,尤其是 T 细胞免疫和癌症免疫治疗。例如,铁死亡的癌细胞释放高迁移率族蛋白1 (HMGB1) 调节免疫相关炎症反应,并使骨髓衍生树突细胞 (BMDC) 激活和成熟。反过来,免疫激活的 T 细胞可以释放高水平的干扰素-γ(IFN-γ),以增强肿瘤细胞中铁死亡特异性脂质过氧化物,这种增强的铁死亡有助于抗肿瘤免疫功效。受上述免疫支持案例的启发,研究人员认为,将外泌体抑制和铁死亡的免疫原性优势直接联系起来可能会建立一种有效的免疫治疗策略。到目前为止,还没有研究关注这种联系。这种方法可以减少由外泌体 PD-L1 引起的全身免疫抑制,放大肿瘤细胞的铁死亡并提升全身抗肿瘤免疫反应。在这项工作中,研究人员将小分子 GW4869 用于外泌体途径的抑制。这种外泌体抑制剂的疏水性提示我们将亲水性透明质酸(HA)与疏水性 5β-胆酸(CA)结合,首先将这种合成的 HACA 载体功能化为两亲性(如图a所示)。Fe3+ 作为铁死亡诱导剂,通过多酚与 HACA 配位,形成 HACA-Fe 纳米颗粒 (NPs)。将 GW4869 外泌体抑制剂封装到 HACA-Fe 的疏水相中,实现了 HGF 纳米单元的最终产品。如图1b所示,GW4869的抑制性能降低了肿瘤来源的外泌体的分泌,并间接削弱了外泌体PD-L1的免疫抑制力。因此,免疫活性T细胞被解放,分泌反应性 IFN-γ 细胞因子,从而减少肿瘤细胞 SLC7A11 和 SLC3A2、胱氨酸/谷氨酸转运蛋白表达。这些蛋白都在维持细胞摄取胱氨酸和谷氨酸以进行抗氧化方面发挥关键作用,其下调不可避免地增强了脂质过氧化作用。此外,由HGF 提供的富集铁例子进一步增强了癌细胞的铁死亡。为了检测 HGF 的抗肿瘤性能,研究人员建立了多个 B16F10 黑色素瘤模型。单一HGF 抑制肿瘤生长并成功刺激持久的免疫记忆。与 PD-L1 检查点阻断相结合,HGF 弥补了游离抗体的治疗局限性,包括 T细胞的功能优化和肿瘤转移的抑制。这种新设计的 HGF 将成为下一代癌症免疫疗法的有吸引力的候选者。 参考文献:A nanounitstrategy reverses immune suppression of exosomal PD-L1 and is associated withenhanced ferroptosis. Nat Commun. 2021 Sep 30;12(1):5733. 外泌体资讯网 澳门大学:一种新的纳米单元用于逆转外泌体PD-L1的免疫抑制并增强肿瘤铁死亡