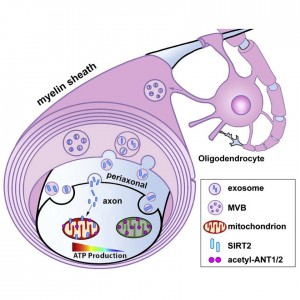
神经元可以维持轴突中的ATP稳态,而轴突非常容易受到生物能量衰竭的影响。来自NIH盛祖杭课题组的研究人员在Neuron杂志上发表论文,阐明了一种跨细胞信号传导机制,揭示了SIRT2经外泌体从少突胶质细胞到轴突的传递,使线粒体蛋白去乙酰化增强ATP的产生,为促进神经系统疾病中的轴突生物能代谢提供了一个靶点。神经元是高度特化的细胞,可产生动作电位、驱动细胞器运输、保持离子梯度并维持神经传递,这些都需要以三磷酸腺苷(ATP) 形式存在的大量能量的支持。由于长轴突内的ATP 扩散效率低下,某些外周神经可以延伸到几英尺,神经元需要维持远端轴突和突触局部 ATP供应,因此特别容易出现生物能衰竭引起的轴突病理学和神经退行性疾病,包括阿尔茨海默病、帕金森病、亨廷顿病、肌萎缩侧索硬化和多发性硬化症(MS)等。因此,揭示维持轴突能量供应的机制是治疗研究的新兴前沿。 大约860亿个神经元和840亿个神经胶质细胞连接在一起形成了人脑中的复杂网络。轴突对于能量维持和调节依赖于神经胶质细胞,包括小胶质细胞、星形胶质细胞和少突胶质细胞 (OL)。OL是围绕在中枢神经系统(CNS) 轴突的髓鞘形成细胞。髓鞘形成后,轴突节间脱离了细胞外环境,而郎飞节的节点则暴露在细胞外环境中。这种独特的结构使OL帮助轴突进行能量代谢。这一观点得到了一项研究的支持,该研究通过有针对性地去除OL细胞体,从髓鞘绝缘中分离OL的功能,尽管没有明显的脱髓鞘现象,但仍显示轴突性疾病。MS中的脱髓鞘轴突包含有更多的线粒体。同样,OL细胞中缺乏蛋白脂蛋白 1 (PLP1) 的小鼠会导致遗传性痉挛性截瘫,尽管保留了髓鞘,但仍会出现功能失调的轴突线粒体的积累。这些研究强调了轴突退化、能量危机和OL功能障碍之间的潜在联系。 当神经元在血糖升高期间缺乏能量底物时,OL将乳酸传递到轴突并通过将能量底物传递到轴突来支持神经元活动。然而,在葡萄糖可自由获得的稳态条件下,OL是否主动调节轴突生物能量仍然很大程度上未知。维持轴突线粒体生物能量的信号通路已成为轴突完整性和功能的关键调节者。揭示这一问题将从根本上推进我们对轴突中线粒体能量代谢如何维持和促进以响应生理和病理条件下局部能量需求变化的理解。 在这项研究中,研究人员揭示了一种跨细胞信号传导机制,OL通过该机制促进轴突线粒体 ATP 的产生。在微流体装置的实时成像分析中,使用最先进的ATP传感器,研究人员证明 OL通过改变关键线粒体蛋白质的乙酰化来增加轴突隔室内的能量使用。NAD依赖性去乙酰化酶Sirtuin 2 (SIRT2) 在神经元中不存在,但在成熟OL中高度表达,并通过外泌体中释放到细胞外。神经元中SIRT2的外源性表达增强了轴突ATP水平。通过删除小鼠中的 sirt2基因、敲低 OL中的SIRT2 蛋白或阻止 OL细胞的外泌体释放,研究人员证明SIRT2 从OL到轴突的跨细胞传递增强了轴突ATP的可用性。细胞间线粒体转移已成为治疗开发的一种可能途径,该研究结果表明,外泌体介导的跨细胞信号传导是一种有效且稳健的机制,可提高轴突内线粒体的能量容量。 参考文献:Oligodendrocytes enhance axonal energy metabolismby deacetylation of mitochondrial proteins through transcellular delivery ofSIRT2. Neuron. 2021 Nov 3;109(21):3456-3472.e8.外泌体资讯网 Neuron:少突胶质细胞通过传递外泌体SIRT2增强轴突能量代谢