肝病每年导致全球约120万人死亡,占全球所有死亡人数的3.5%。急性肝损伤通常是可逆的,而慢性肝损伤通常会导致肝脏炎症、脂肪肝疾病、肝纤维化、肝硬化和肝细胞癌 (HCC)。慢性肝损伤和持续炎症过程会刺激纤维化并导致肝硬化、HCC和随后的肝功能衰竭。目前,全球有15亿人受到多种形式的慢性肝病(CLD)的影响。肝纤维化被认为是肝脏结构恶化的汇聚点。近年来,由于肝炎、非酒精性脂肪性肝炎(NASH)、慢性乙醇消耗(饮酒)、代谢综合征等,肝硬化的发病率及其相关死亡率急剧增加。肝细胞来源的外泌体调节肝脏再生和邻近肝细胞和非实质细胞的修复,如肝星状细胞(HSC)、肝窦内皮细胞(LSEC)、库普弗细胞或浸润性免疫细胞。HSCs、LSECs和胆管细胞也分泌外泌体,调节肝损伤后的肝脏重塑。然而,慢性肝损伤后,肝细胞分泌含有多种促纤维化信号分子的外泌体,进而激活其他肝细胞进行增殖。此外,越来越多的证据也证实,肝脏疾病及其进展通常与源自或转移到HSC和其他存在于窦周空间的细胞的细胞外囊泡有关。因此,该综述重点关注HSC衍生的细胞外囊泡的作用及其在肝纤维化过程中与窦周环境中细胞群的相互作用。
由于所有肝实质和非实质细胞群之间结构良好的串扰,肝脏的复杂功能活动得到精心安排。涉及肝脏中各种细胞类型释放的细胞外囊泡(EV)的旁分泌相互作用是重要的细胞间通讯工具。在正常肝脏中,静止的肝星状细胞(HSC)释放的EV调节细胞再生、存活、细胞分化、细胞迁移和免疫反应。慢性肝损伤后,HSC被激活,获得类似肌成纤维细胞(MFB)的表型,并异常分泌细胞外基质蛋白,从而产生纤维瘢痕。为了维持受损肝脏的病理状态,活化的HSC会分泌含有促纤维化内容物的特定EV,这些EV与肝细胞、静止的HSC、肝窦内皮细胞(LSEC)和窦周和窦状隙中的库普弗细胞相互作用。激活的HSC分泌富含miR-192、血小板衍生生长因子受体和凋亡信号调节激酶1的EV,通过雷帕霉素和Rho相关蛋白激酶1信号轴的机制靶向激活静止的HSC,称为“水平转移”过程。同时,受损的肝细胞衍生的促炎miRNA(miR-19a和-192)和富含转化生长因子-β的外泌体将分别激活库普弗细胞和HSC上的toll样受体-9和-3,以获得纤维化表型。库普弗细胞和LSEC释放分别含有miR-103-3p和鞘氨醇激酶1的外泌体,激活HSC。来自衰老HSC的富含表皮生长因子的外泌体增加了肝癌细胞的活力。因此,窦周空间是一个关键的微环境,它协调纤维化肝病中由HSC、肝细胞、LSEC和库普弗细胞介导的各种细胞间信号传导。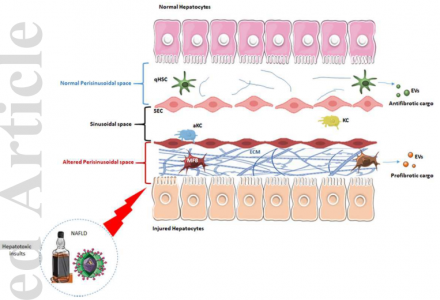
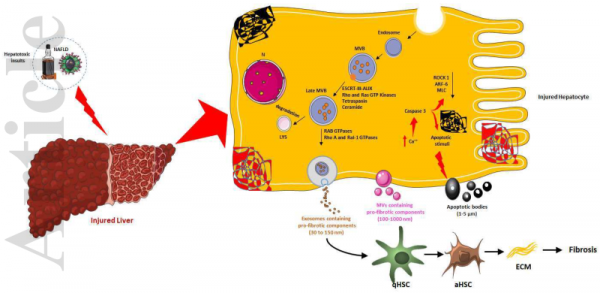
从受损肝细胞合成的细胞外囊泡(EV)的生物发生和类型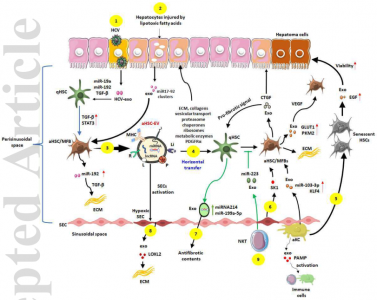
DevarajE, Perumal E, Subramaniyan R, Najimi M. Liver fibrosis: extracellularvesicles mediated intercellular communication in perisinusoidal space. Hepatology.2021 Nov 13. doi: 10.1002/hep.32239. Epub ahead of print. PMID: 34773651.外泌体资讯网 【综述】Hepatology:细胞外囊泡介导肝纤维化过程中窦周间隙的细胞间通讯