癌细胞分泌的细胞外囊泡(EV)可用于诊断和疾病监测。来自帝国理工学院的研究人员开发了一种高通量无标记细胞外囊泡的分析方法,以微创方式诊断和监测癌症,并消除系统偏差,这种单粒子自动拉曼捕获分析系统(SPARTA)将成为专为EV的单粒子分析的专用独立设备。该研究发表于ACS Nano杂志上。乳腺癌是女性最常见的癌症类型,2020年全球新确诊病例超过200万。癌细胞分型对预后和确定有效的治疗策略有重大影响,因此快速准确的诊断对于有效治疗乳腺癌至关重要。最普遍的乳腺癌诊断模式是基于体格检查、影像学检查,如果怀疑为恶性肿瘤,则先进行活检,然后进行组织病理学筛查。这些方法的主要缺点是具有侵入性以及因活检定位不准确而发生采样误差。此外,X射线筛查和组织病理学评估在很大程度上取决于专家的个人判断,报告常存在个人和实验室之间的差异。这些限制表明,对于乳腺癌诊断需要无创和微创技术并减少解释变异性和偏差的方法。
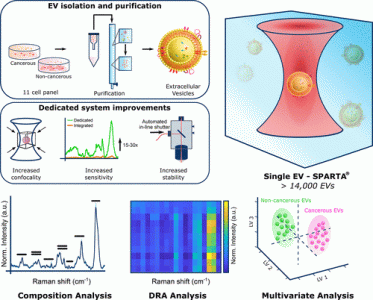
拉曼光谱具有一些吸引人的特征,可以用于临床乳腺癌诊断和疾病监测。作为一种基于光谱的技术,拉曼光谱通常是无标记且无损的,因此可以直接在体外或体内测量样品。它也可以自动化,用于数据采集和分析,在很大程度上消除人员的参与和偏差。源自各种类型乳腺癌的细胞系、原代细胞和组织已被进行了大量拉曼光谱研究。此类研究表明,癌组织通常表现出脂质消耗和蛋白质富集,不同乳腺癌的类型具有不同的脂质与蛋白质比例。相反,单个癌细胞显示出脂质含量的整体增加。因此,通过识别提取的癌组织,拉曼光谱可以潜在地减少人员误差。然而,通过活组织检查提取组织是一种侵入性方法,不能频繁或常规进行。液体活检(最常见的是血液样本)已显示出作为活检的微创替代方法。血液传播的实体,如循环肿瘤细胞、循环肿瘤DNA和肿瘤衍生的细胞外囊泡 (EV) 都是潜在的生物标志物。 EV是由大多数细胞类型释放的纳米级脂质囊泡,可以将蛋白质和核酸转移到受体细胞。EVs 是一种肿瘤细胞分泌因子,有助于形成转移前生态位并指导转移性器官向性,并且越来越多地认识到其作为癌症生物标志物的潜力。初步研究显示拉曼光谱应用于癌症起源的 EV分析。自发拉曼光谱、激光捕获拉曼光谱、表面增强拉曼光谱 (SERS) 和SERS活性纳米标签都已应用于获取癌细胞EV的指纹光谱。这些先前的工作表明,来自各种细胞系的 EV的光谱明显不同,并且细胞分泌组中存在EV亚群,这些亚群与各种EV功能相关。然而,揭示EV的完整复杂性及其在癌症生物学中的基本作用需要高通量自动化技术,这样才能发挥拉曼光谱在分析和最终诊断癌症方面的全部优势。在这项研究里,研究人员应用于最新开发的高通量单粒子自动拉曼捕获分析 (SPARTA) 平台,研究EV作为乳腺癌生物标志物的潜力。为了最大限度地提高基于EV的癌症生物标志物的科学准确性和临床相关性,必须解决许多关键的内在和外在实验参数。外在因素包括使用适当的非癌细胞对照来确认系统区分癌性EV的能力、使用共聚焦系统对单个EV进行表征以限制污染物产生的光谱信号、获取每个样品的高测量值(> 100)增加数据的可靠性、使用EV分离方法限制细胞蛋白质和碎片的共沉淀。内在因素与使用激光捕获拉曼光谱系统有关,该系统可以分析天然状态下的无标记 EV,这是使用SERS方法无法实现的,因为EV必须在SERS基板上干燥或用SERS纳米结构进行功能化。本研究通过使用 SPARTA平台全面解决所有这些外在和内在研究参数,从而改进了现有技术。 研究人员对SPARTA平台进行了重新设计,从集成到商用拉曼显微光谱仪的系统到针对EV 成分分析优化的专用定制仪器。研究人员展示了对源自非癌性乳腺细胞和乳腺癌细胞系的单个EV的高效自动捕获。分析了来自11种乳腺细胞类型的一整套EV,反映了各种来源(包括非癌、原发性和转移性癌)和各种受体状态(包括HER2+、ER+、三阴性)。获得了超过14000个单独的EV光谱并进行成分差异分析,这是基于使用降维阵列(DRA)分析的拉曼光谱可视化方法。研究人员证明专用的SPARTA系统可以以高度的敏感性和特异性(两者均> 95%)区分癌症和非癌症EV。进一步研究表明,该方法的预测能力在来自相同细胞类型的多个EV分离中是一致的。详细的建模揭示了源自各种密切相关的乳腺癌亚型的 EV 之间的准确分类,进一步支持了基于SPARTA的方法用于详细EV分析。 参考文献:Single Particle Automated RamanTrapping Analysis of Breast Cancer Cell-Derived Extracellular Vesicles asCancer Biomarkers. ACS Nano. 2021 Nov 4. doi: 10.1021/acsnano.1c07075. Epubahead of print.外泌体资讯网 ACS Nano:单粒子自动拉曼捕获分析乳腺癌细来源生的细胞外囊泡